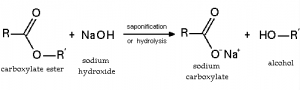
Modelo atómico de Bohr
La teoría atómica ha recorrido un largo camino en los últimos miles de años. Comenzando en el siglo V a. C. con la teoría de Demócrito, avanzando hacia el modelo atómico de Dalton en el siglo XVIII y madurando en el siglo XX con el descubrimiento de partículas subatómicas y teoría cuántica. el viaje del descubrimiento ha sido largo y sinuoso. Pero podríamos pensar que uno de los hitos más sobresaliente que se han dado en este largo camino ha sido sin duda el modelo atómico de Bohr, también conocida como el modelo atómico de Rutherford-Bohr. Propuesto por el físico danés Niels Bohr en 1913, este modelo representa al átomo como un pequeño núcleo con carga positiva rodeado de electrones que viajan en órbitas circulares alrededor del centro.
Temas relacionados
Modelo atómico de Dalton, modelo atómico de Rutherford, modelo atómico de Schródinger, modelo atómico de Sommerfeld, modelo atómico de Thomson
¿Qué es el modelo atómico de Bohr?
Este modelo atómico es una representación del átomo propuesta por Niels Bohr, que establece que el electrón tienen la capacidad de desplazarse en órbitas a una distancia determinada alrededor del núcleo del átomo, en un movimiento circular uniforme.
En qué consiste el modelo atómico de Bohr
Consistía en una teoría que nos decía que cada vez que el electrón cambiaba de órbita, podía emitir o absorber energía en cantidades fijas que eran conocidas como “quanta”. Bohr explicó en su teoría que cuando un electrón se mueve de una órbita a otra y se dirigía hacia el núcleo, se presentaba una pérdida de energía y se emitía luz, con longitud de onda y energía características.
El modelo atómico de Bohr refinó algunos de los elementos del modelo de Rutherford que eran problemáticos. Estos incluyen los problemas que surgen de la mecánica clásica, que predijo que los electrones liberarían radiación electromagnética mientras orbitan un núcleo. Debido a la pérdida de energía, el electrón debería haber girado rápidamente hacia adentro y colapsado en el núcleo. En resumen, este modelo atómico implicaba que todos los átomos eran inestables.
Características
Las principales características del modelo atómico de Bohr fueron las siguientes:
- El modelo se apoyaba en otros modelos y teorías de la época, principalmente en el modelo atómico de Rutherford y en ideas de Einstein.
- Fue el primer modelo que incorporó la teoría cuántica.
- Los átomos absorben o emiten radiación únicamente cuando los electrones saltan entre las órbitas permitidas.
- Los electrones existen en niveles de energía y están rodeando el núcleo.
- Los electrones se describen en números cuánticos.
- La energía existe en función del número n o número cuántico principal.
- Sin energía no hay movimiento del electrón
- El quantum era la energía necesitada por un electrón para pasar de un nivel a otro.
- El nivel de energía más bajo que ocupa un electrón se conoce con el nombre de “estado fundamental”.
- El “estado excitado” es un estado más inestable, resultado del paso de un electrón a un orbital de mayor energía.
- Los electrones giran en órbitas circulares sin irradiar energía
Postulados del modelo atómico de Bohr
Bohr expuso los siguientes tres postulados:
- Primer postulado: explicaba que el electrón da vueltas alrededor del núcleo en órbitas que al mismo tiempo dibujaban círculos, pero que no irradiaban energía y que en esas órbitas el momento angular orbital es constante. Los electrones que tenían solo un átomo tenían órbitas con radios determinados que correspondían a los niveles de energía que ya habían sido definidos.
- Segundo postulado: explicaba que no todas las órbitas eran posibles, pero que cuando el electrón está en una órbita que sí es permitida, tiene un estado de energía específica y constante y no puede emitir energía.
- Tercer postulado: decía que un electrón tiene la capacidad de cambiar de una órbita estacionaria de energía a otra por medio de la emisión o de la absorción de energía.
Aportaciones
Sus aportes se consideran como los más importantes del siglo XX al mundo de la química, la física y las ciencias. El modelo atómico descubierto por Niels Bohr es considerado como uno de los más importantes aportes al mundo de la física y las ciencias en general.
Fue el primero en hablar del átomo como un núcleo con carga positiva rodeado de electrones orbitando. Descubrió el funcionamiento interno de un átomo, que los electrones son capaces de orbitar de manera independiente alrededor del núcleo.
A partir de su interpretación del modelo atómico, Bohr pudo estructurar detalladamente la tabla periódica de elementos que existía en su tiempo y afirmó que las propiedades químicas y la capacidad de enlace de un elemento estaba relacionada con su carga de valencias. Los trabajos de Bohr en la tabla periódica dieron desarrollaron un nuevo campo de la química: la química cuántica.
Experimento
Su experimento consistió en estudiar el átomo de hidrógeno con un protón y un electrón. Lo que hizo fue analizar los espectros de absorción y emisión calentando el átomo para que emitiera luz en el átomo. Con su experimento llegó a la conclusión de que el electrón giraba en órbitas esféricas alrededor del protón.
Qué problemas presenta el modelo atómico de Bohr
La teoría del modelo atómico de Bohr tuvo tres problemas principales o limitaciones importantes que fueron las siguientes:
- La teoría se adapta al espectro del átomo de hidrógeno pero no se adapta a los espectros que tienen otros átomos.
- Las propiedades ondulatorias que posee el electrón no se encontraban representadas en la descripción del mismo como una partícula pequeña que giraba alrededor del núcleo atómico.
- Bohr no pudo explicar por qué el electromagnetismo clásico no podía ser aplicado a su modelo. Es decir, no pudo explicar el por qué los electrones no emiten radiación electromagnética cuando están en una órbita estacionaria.
Importancia
Gracias a Rutherford se pudo llegar a la conclusión de un modelo planetario del átomo; o sea, de electrones que se encontraban orbitando alrededor de un núcleo.
La teoría de Bohr, aunque no es considerada como una teoría exacta, es muy importante a nivel histórico, ya que fue el primer modelo en incluir y postular una cuantización, la cual nos dice la manera en la que los electrones pueden tener órbitas estables alrededor del núcleo del átomo.
¿Cómo citar este artículo?
Briceño V., Gabriela. (2018). Modelo atómico de Bohr. Recuperado el 25 febrero, 2024, de Euston96: https://www.euston96.com/modelo-atomico-bohr/