
La historia del átomo se remonta al siglo V a. C., cuando Demócrito de Abdera, filósofo y matemático de la antigua Grecia (460 a. C. – 360 a. C), concibió la idea de que la materia estaba formada por unas diminutas partículas a las que llamó «átomon», en griego ἄτομον.
Sin embargo, el primer modelo atómico con bases científicas no llegó hasta el siglo XIX. Entre 1803 y 1807, John Dalton enunció los que hoy conocemos como postulados de Dalton y que resumen las ideas principales de su teoría atómica.
Dalton se dedicó a la física, la química y la meteorología, y centró gran parte de su trabajo en el estudio de los gases. En el transcurso de sus experimentos, Dalton llegó a resultados muy importantes en química, como la Ley de las Presiones Parciales.
Pero sin duda lo más importante de sus resultados es que podía explicarlos si la materia estaba formada por unidades enteras de partículas. Con su teoría atómica y postulados, Dalton consiguió hacer de la teoría atómica una disciplina verdaderamente científica, pues llegó a sus conclusiones a través de la experimentación y análisis de los resultados desde un punto de vista empírico.
Índice de contenido
Postulados de Dalton
Según la lectura que realizó Dalton en 1803 ante la Royal Institution, la materia estaba formada por átomos que constituyen elementos, y estos elementos se combinan entre sí para formar los distintos compuestos.
La teoría atómica de Dalton se puede resumir en unos pocos enunciados, los llamados postulados de Dalton. El número de postulados es muy variable según diferentes fuentes, generalmente entre 4 y 6, aunque las ideas generales siempre son las mismas:
- La materia está formada por diminutas partículas indivisibles llamadas átomos.
- Un elemento está formado por átomos iguales caracterizados por la misma masa y tamaño.
- Los átomos son indivisibles, pero se pueden combinar en reacciones químicas para formar los compuestos.
- La combinación de átomos se produce en proporciones de números enteros, por ejemplo 1:1, 1:2, 2:3, etc (proporciones estequiométricas).
- La combinación de los mismos átomos pero en proporciones diferentes da lugar a diferentes compuestos (ley de proporciones múltiples).
Principales aportes del modelo atómico de Dalton
Los experimentos químicos de Dalton se basaron en dos teorías previas: la ley de la conservación de la masa, postulada por Antoine Lavoisier en 1789, y la ley de las proporciones constantes, atribuida a Joseph Proust, también de finales del siglo XVII.
La ley de la conservación de la masa sostiene que en el transcurso de una reacción química la masa permanece constante. Es decir, que la suma de la masa de los reactantes es igual a la suma de la masa de los productos.
La ley de las proporciones constantes, por su parte, sostiene que un determinado compuesto químico siempre está formado por la misma proporción de elementos.
En el transcurso de sus investigaciones sobre los gases, Dalton descubrió que ciertos gases se combinaban solo en determinadas proporciones, incluso si eran compuestos diferentes pero compartían elementos comunes.
Con estas observaciones y las leyes anteriores, Dalton postuló la Ley de las Proporciones Múltiples. Esta ley sostiene que si dos elementos se pueden combinar en diferentes proporciones, formarán diferentes compuestos, lo que no contradice la ley de la proporciones constantes, pues cada compuesto sigue caracterizándose por una proporción constante.
Por ejemplo, 12 g de carbono se pueden combinar con 16 g de oxígeno para formar monóxido de carbono (CO), pero 12 g de carbono también se pueden combinar con 32 g de oxígeno para formar dióxido de carbono (CO2).
Dalton dedujo que esto se debía al peso atómico, característica única para cada elemento o tipo de átomo, e introdujo el concepto de peso atómico relativo. Esto permitió entender por primera vez las relaciones estequiométricas de las reacciones químicas. También explicaba como era posible la existencia de tantas sustancias con un número reducido de elementos.
Dalton tomó el átomo de hidrógeno como referencia y le dio un peso relativo de 1. Comparando las proporciones de masa en las que se combinaban los elementos, pudo ordenar muchos de ellos según el peso relativo de sus átomos. No se sabe como llegó a determinar que el hidrógeno era el elemento más ligero.
Con la idea de las partículas y el peso atómico relativo como característica única de cada elemento, Dalton desarrolló su teoría atómica que se resume en las siguientes ideas:
- un elemento puro consiste en partículas indivisibles llamadas átomos
- los átomos de un elemento son todos iguales
- los átomos de diferentes elementos se pueden identificar por su peso atómico
- los átomos de los elementos se combinan para formar compuestos químicos
- en las reacciones químicas los átomos se combinan, pero no se destruyen ni se crean.

Principales fallos del modelo atómico de Dalton
Dalton consideraba un átomo como una partícula elemental e indivisible, pero trabajos posteriores, como los realizados por J. J. Thomson, Ernest Rutherford o Neils Bohr, revelaron una estructura atómica mucho más compleja de la que Dalton intuyó.
Por ejemplo, en el modelo atómico de Bohr, la distribución de cargas en los átomos no es homogénea, sino que está separada entre los electrones, en una capa externa, y los protones y neutrones, localizados en el núcleo.
Hoy ya se sabe que incluso estas partículas están constituidas a su vez por partículas más pequeñas y elementales.
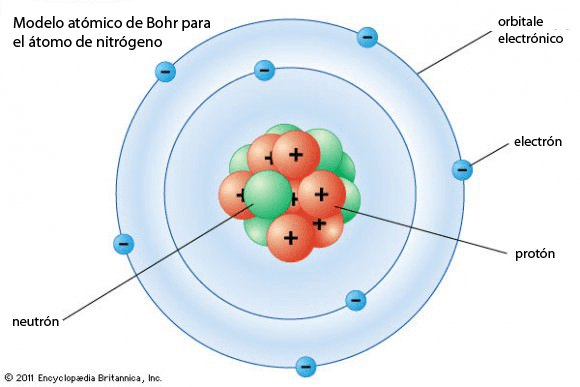
Hoy también sabemos que el peso atómico es producto de la propia estructura del átomo y que el átomo de un elemento no siempre es igual, existen los isótopos, algo que Dalton no llegó a intuir.
Aún así, la contribución de Dalton a la ciencia fue enorme. Antes de sus postulados el átomo era una construcción filosófica, pero a partir de sus estudios se convirtió en una realidad científica que hizo posible seguir avanzando en el conocimiento del mundo físico.