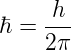El conocido como Principio de Exclusión de Pauli es un principio de la mecánica cuántica que sostiene que dos o más partículas idénticas de tipo fermión, es decir, partículas con espín semi-entero, no pueden estar u ocupar en el mismo estado cuántico simultáneamente dentro del mismo sistema.
Dicho de otro modo, dos fermiones no pueden tener todos sus números cuánticos iguales. Y dicho de forma más técnica, dos fermiones idénticos dentro del mismo sistema cuántico presentan una función de onda antisimétrica.
Los bosones, a diferencia de los fermiones, tienen espín entero y no están sometidos al Principio de Exclusión de Pauli. Por ejemplo, los fotones son un tipo de bosón, por lo que cualquier número de fotones pueden ocupar el mismo estado cuántico de forma simultánea y su comportamiento se corresponde con una función de onda simétrica.
Tener el espín semi-entero (1/2, 3/2, etc) significa que el momento angular intrínseco es igual a la conocida como constante de Planck reducida o constante de Dirac:
En consecuencia, los fermiones (quarks y leptones), según la mecánica cuántica, se presentan en estados asimétricos cuya distribución es explicada a través de la estadística de Fermi-Dirac. Por su parte, los bosones (fotones, pares de Cooper, bosones W y Z, etc) tienen un espín entero y se distribuyen según la estadística de Bose-Einstein.
Además de las partículas elementales, los átomos y partículas compuestas también pueden obedecer al Principio de Exclusión de Pauli según su espín global.
Por ejemplo, el Helio-3 tiene un espín de 1/2 y sería un fermión que obedece el Principio de Exclusión, mientras que el Helio-4 tiene un espín igual a cero y sería un bosón, lo que pone de manifiesto a temperaturas cercanas al cero absoluto cuando el helio-4 comienza a comportarse como un superfluido.
Principio de Exclusión de Pauli en los electrones
El Principio de Exclusión de Pauli debe su nombre a su autor, Wolfgang Pauli, quien enunció este principio en 1925. En un primer momento, Pauli lo aplicó a los electrones, y fue posteriormente cuando se aplicó al resto de fermiones: a los quarks, que forman los protones y los neutrones, y a los leptones, grupo al que pertenecen los electrones y los neutrinos.
Cada electrón dentro de un átomo queda definido completamente a través de cuatro números cuánticos:
- n: número cuántico principal. Representa el nivel energético del electrón y está relacionado con la distancia media entre el núcleo y el electrón.
- l: número cuántico azimutal, número cuántico de momento angular o número cuántico secundario. Indica subniveles energéticos y se relaciona con la forma del orbital electrónico.
- m, ml: número cuántico magnético. Indica la orientación espacial del subnivel energético u orbital electrónico.
- s, ms: número cuántico de espín. Indica el momento angular intrínseco y se relaciona con el giro del electrón sobre sí mismo. El electrón puede girar en el mismo sentido que gira en el orbital o en sentido contrario, y puede tomar solo dos posibles valores, 1/2 y -1/2.
Si dos electrones tienen el mismo n, l y m, entonces ocuparán el mismo orbital, el mismo subnivel de energía y en la misma orientación espacial, pero para ello tienen que tener diferente espín. Uno de los cuatro números cuánticos tiene que ser diferente para que puedan ocupar exactamente el mismo orbital, uno tendrá espín 1/2 y otro -1/2.
Tomemos como ejemplo la configuración electrónica del Argón:
Esto quiero decir que los 18 electrones del argón se distribuyen en tres niveles energéticos, y dentro de cada nivel, en varios subniveles o tipos de orbitales:
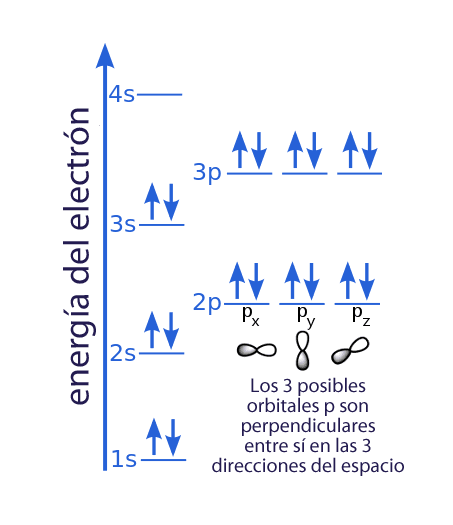
- Nivel 1: puede albergar dos electrones con los mismos números n, l y m, pero con espín opuesto para obedecer el principio de exclusión de Pauli.
- Nivel 2: En el nivel 2 de energía hay dos subniveles, el subnivel 2s y el subnivel 2p, y dentro del subnivel p hay tres posibles orbitales perpendiculares entre sí según su momento angular magnético (px, py y pz). Así, el nivel 2s puede albergar otros 2 electrones y el nivel 2p puede albergar un total de seis electrones.
- Nivel 3: Similar al nivel 2 pero con un número cuántico principal mayor.
De forma gráfica se podría representar de la siguiente forma (cada flecha arriba o abajo representa un electrón con espín positivo o negativo):
Una de las consecuencias del Principio de Exclusión de Pauli es la elaborada capa electrónica de los átomos y explicaría como los átomos se combinan entre sí, la estabilidad de la materia a gran escala y otros muchos fenómenos a los que responde la materia ordinaria.