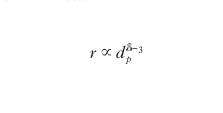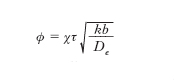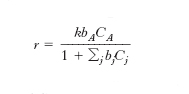Catalisi
Enciclopedia on line
Fenomeno in virtù del quale una sostanza, detta catalizzatore, presente anche in piccola quantità, modifica la velocità di una reazione chimica, senza entrare a far parte della composizione dei prodotti finali e senza variare lo stato di equilibrio della reazione stessa. La c. ha un notevole interesse applicativo poiché sta alla base di gran parte dei processi della chimica industriale.
Caratteri generali
La c. è detta omogenea quando il catalizzatore è presente nella stessa fase (per lo più gassosa o liquida) dei reagenti ed eterogenea quando il catalizzatore è presente in una fase distinta (solitamente solida). Un esempio di c. omogenea è la c. acido-base, che interessa i processi di esterificazione, saponificazione, inversione, mutarotazione e varie ossidazioni e riduzioni in soluzione. Nel caso delle reazioni catalizzate dagli acidi, si distingue fra una c. acida specifica, in cui l’azione catalitica viene esercitata dagli idrogenioni, e una c. acida generale, in cui anche l’acido indissociato agisce come catalizzatore; analogamente si ha una c. basica specifica e una c. basica generale. L’effetto catalitico è inerente alla maggiore rapidità del processo di trasferimento del protone rispetto al normale processo di formazione o rottura dei legami chimici molecolari. In generale una reazione catalitica si svolge attraverso una successione di stadi in cui sono coinvolte delle specie instabili molto reattive chiamate centri attivi, mediante sequenze chiuse o cicli catalitici. Per es. una reazione del tipo
A + B ⇄ M + N,
se si indica con σ il centro attivo può essere spezzata nelle due reazioni:
A + σ → A − σ
A − σ + B → M + N + σ .
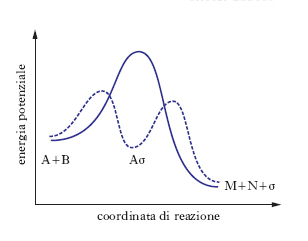
L’aggiunta del catalizzatore modifica la superficie di energia potenziale che descrive l’evoluzione molecolare del sistema reagente nel passaggio dai reagenti ai prodotti, facendo intervenire un cammino alternativo (➔ cinetica). La situazione è illustrata nel diagramma energetico riportato nella fig., dove vengono illustrati entrambi i cammini di reazione: rispettivamente in assenza del catalizzatore, curva continua, e in presenza del catalizzatore, curva tratteggiata. In quest’ultima è presente un minimo corrispondente alla formazione di un composto intermedio fra reagente e catalizzatore. Esempi di c. operante attraverso la formazione di un composto intermedio si riscontrano anche negli organismi viventi grazie all’azione esercitata dagli enzimi che sono particolari proteine. Le caratteristiche tipiche di questi processi sono la specificità del substrato, l’assenza di sottoprodotti (la resa di tali reazioni è vicina al 100%) e le particolari leggi cinetiche che le regolano.
Classificazione dei catalizzatori
Ai catalizzatori eterogenei appartiene un’ampia varietà di solidi che comprende i metalli e le leghe e diversi ossidi metallici, impiegati puri o in presenza di particolari additivi. La classificazione del loro comportamento catalitico riportata nella tabella è stata formulata sulla base di due caratteristiche: le loro proprietà chimico-fisiche, incluse quelle strutturali, e la natura delle reazioni nelle quali sono attivi. Tenendo conto di entrambi i fattori viene fatta una distinzione fra i metalli nei quali il legame è dovuto agli elettroni mobili, i solidi covalenti nei quali i legami sono dovuti alla condivisione di una coppia di elettroni e includono particolari ossidi e sali, e infine i solidi costituiti da ioni legati fra di loro dalle interazioni elettrostatiche. Alcuni ossidi, quali Al2O3 e SiO2, che hanno legami ionici con parziale carattere covalente, hanno una particolare importanza nella c. sia per le loro funzioni acido basiche superficiali sia perché, unitamente ad altri, quali MgO, vengono ampiamente impiegati come supporti, in particolare per catalizzatori metallici.
Quanto al modo di impiego dei diversi catalizzatori, i metalli vengono utilizzati in forma di polveri, ottenute per es. per riduzione di sali, di film ottenuti per deposizione chimica da fase vapore di composti termolabili, e infine soprattutto sotto forma di dispersioni di piccole particelle cristalline su opportuni supporti, quali l’allumina, la silice, la zirconia, gli ossidi di magnesio, il carbone ecc. Gli ossidi vengono impiegati puri o impregnati con un solido diluente, sotto forma di particelle porose di diversa forma e dimensioni le cui caratteristiche spesso intervengono anche nei processi di trasporto di materia e calore, i quali influiscono talora in modo significativo sulle caratteristiche tecnologiche dell’intero sistema catalitico. In tutti: casi menzionati si tende comunque ad avere elevate superfici specifiche che raggiungono le centinaia di m2/g.
C. eterogenea
Le ricerche fondamentali che vengono condotte nel campo della c. eterogenea sono volte all’identificazione della natura dei gruppi chimici funzionali esistenti sulla superficie del solido e delle loro interazioni con i reagenti. In questa impostazione i principali concetti interpretativi che vengono utilizzati riguardano rispettivamente la struttura della superficie, la natura dei difetti superficiali, le proprietà elettroniche del solido e quindi l’individuazione dei centri attivi superficiali costituiti da gruppi di atomi in particolari condizioni geometriche e fisiche. Infatti gli atomi di una superficie possono manifestare una diversa attività, come è stato messo in evidenza per la prima volta da I. Langmuir. Il concetto di centro attivo nella c. è stato introdotto da F. Taylor evidenziando che l’ammontare di una superficie che risulta cataliticamente attiva dipende dalla reazione catalizzata, per cui si possono verificare tutte le situazioni fra i casi estremi in cui tutti gli atomi della superficie sono attivi e quello in cui solo pochi di essi lo sono. L’interpretazione del meccanismo delle reazioni catalitiche eterogenee viene condotto attraverso l’applicazione di metodologie chimico-fisiche in grado di approfondire i più sottili dettagli della composizione, della struttura e della configurazione energetica delle superfici solide e la natura e le caratteristiche delle specie chimiche più abbondanti presenti sulla superficie (MASI, most abundant surface intermediates). Di particolare rilevanza è la spettroscopia in situ, che pone l’attenzione sia sul catalizzatore, cercando di catturare il suo stato di ossidazione e la struttura geometrica dei centri attivi mediante metodi spettroscopici, sia sul meccanismo delle reazioni catalitiche e la natura degli intermedi coinvolti.
Una reazione catalitica eterogenea si svolge attraverso una successione di stadi:
a) diffusione delle molecole reagenti verso la superficie;
b) chemiadsorbimento delle stesse sui centri attivi;
c) reazione chimica sui centri attivi;
d) deadsorbimento dei prodotti di reazione;
e) diffusione dei prodotti verso la massa fluida.
Inoltre occorre considerare anche la diffusione del reagente all’interno dei pori. Per approfondire come quest’ultimo fattore condizioni la velocità di un processo catalitico è opportuno riferirsi alla situazione semplificata di un poro cilindrico di diametro d e lunghezza Lp nel quale entra il reagente che diffonde e viene quindi adsorbito su un punto della superficie dove subisce la trasformazione chimica. La velocità della reazione r, espressa come moli di reagente trasformato per unità di tempo per unità di volume del poro del catalizzatore, si può scrivere come segue:
r = ηrid = ηkbCs .
In essa compare un termine, che definiremo ideale, proporzionale alla concentrazione Cs del reagente in corrispondenza della superficie, moltiplicato per il prodotto della costante di velocità di reazione k per quella dell’equilibrio di adsorbimento b. Il parametro adimensionale η, chiamato efficienza del catalizzatore, riflette l’influenza dei processi diffusivi sulla velocità globale in accordo alla definizione:
Nell’espressione all’ultimo membro, ricavata attraverso l’integrazione dell’equazione differenziale che esprime la competizione fra la velocità della reazione chimica e la diffusione all’interno del poro, tgh indica la tangente iperbolica mentre
è un tipico gruppo adimensionale che compendia l’influenza relativa della reazione chimica e della diffusione; χ è il rapporto fra la superficie e il volume del poro, uguale a (4/d) se è cilindrico, mentre De è il coefficiente di diffusione del reagente nei pori; per piccoli diametri tale diffusione ha luogo con il meccanismo di M. Knudsen che implica una serie di collisioni delle molecole con le pareti dei pori stessi. Infine τ è un parametro chiamato tortuosità, uguale a 1 per pori regolarmente cilindrici, e minore di 1 per i pori la cui irregolarità penalizza la diffusione. I suoi valori sono caratteristici per ciascun catalizzatore e vengono per lo più ottenuti in modo semiempirico attraverso un confronto con i risultati sperimentali. In base alle equazioni precedenti il valore di η è sempre inferiore a 1 e si avvicina all’unità quando il coefficiente di diffusione è molto elevato, per cui la diffusione all’interno dei pori gioca un ruolo modesto sulla velocità del processo globale inclusivo della reazione chimica e dei processi diffusivi.
Nell’analisi precedente si è ignorata per semplicità l’influenza del grado di ricoprimento della superficie sulla velocità della reazione catalitica, che viene espressa da un’equazione cinetica di primo ordine proporzionale alla concentrazione del reagente in corrispondenza della superficie. In realtà se si considera, per es., una reazione monomolecolare del tipo:
A → prodotti
che interviene nei processi concernenti l’isomerizzazione o la decomposizione di una molecola quali le disidratazioni degli alcoli, il cracking degli idrocarburi, e si assume che i processi di adsorbimento si possano considerare all’equilibrio, la velocità della reazione chimica superficiale si potrà allora esprimere come segue:
dove bj è la costante dell’equilibrio di adsorbimento della specie j. La somma al denominatore include tutte le specie che si adsorbono sui centri attivi. Si può osservare che la precedente si approssima a un’equazione cinetica di primo ordine se le concentrazioni sono basse o di ordine zero se sono elevate.
Applicazioni
Circa il 90% delle sostanze chimiche prodotte industrialmente è ottenuto tramite processi catalitici. Esempi di applicazione della c. eterogenea sono le sintesi dell’ammoniaca, dell’acido nitrico, dell’acido solforico, del metanolo, di idrocarburi, di alcoli superiori ecc. I processi catalitici eterogenei comportano in genere minori problemi impiantistici rispetto a quelli omogenei, sia perché consentono una facile separazione dei catalizzatori dai prodotti di reazione, sia perché le sostanze in gioco presentano una minore azione corrosiva. Per questa ragione la c. eterogenea ha trovato finora un’ampia applicazione in campo industriale. Notevole interesse presenta anche la tecnica di fissazione (o immobilizzazione) di catalizzatori omogenei su matrici insolubili costituite, per lo più, da polimeri organici. Questa c., nota come omogenea eterogeneizzata, combina l’alta selettività della c. omogenea con la facilità di separazione dai prodotti di reazione presentata dai catalizzatori eterogenei. Quest’ultimo requisito è particolarmente importante per i catalizzatori molto costosi la cui perdita può compromettere l’economicità del processo. Questa tecnica di fissazione presenta un particolare interesse nell’impiego degli enzimi come catalizzatori industriali (➔ enzima).
© Istituto della Enciclopedia Italiana fondata da Giovanni Treccani - Riproduzione riservata