Ti è mai successo? Si esegue in palestra e si torcere la caviglia. Fa male e inizia a gonfiarsi. Il tuo insegnante afferra il kit di primo soccorso e tira fuori un impacco freddo istantaneo. Dopo una buona compressione, il pacchetto diventa davvero freddo, quasi istantaneamente. Cosa sta succedendo? In che modo le sostanze chimiche rendono il pacco freddo così rapidamente? La risposta può essere trovata in termodinamica! Questa è una branca della scienza che esplora il trasferimento di energia., In termodinamica, le reazioni chimiche possono essere classificate come endotermiche o esotermiche.
Quali sono i due principali tipi di reazioni termodinamiche?
Le reazioni esotermiche sono reazioni che rilasciano energia sotto forma di calore. Probabilmente hai familiarità con molti esempi di queste reazioni. Ad esempio, bruciare benzina nel motore di un’auto è una reazione esotermica. Questo particolare tipo di reazione esotermica è noto come reazione di combustione., Una reazione di combustione si verifica quando un composto, come gli idrocarburi che compongono il combustibile, reagisce con l’ossigeno per formare un nuovo prodotto e produrre calore.
Le reazioni endotermiche sono l’opposto delle reazioni esotermiche. Assorbono l’energia termica dall’ambiente circostante. Ciò significa che i dintorni delle reazioni endotermiche sono più freddi come risultato della reazione. Lo scioglimento del ghiaccio è un esempio di questo tipo di reazione.
Come fai a sapere che tipo di reazione termodinamica sta accadendo?
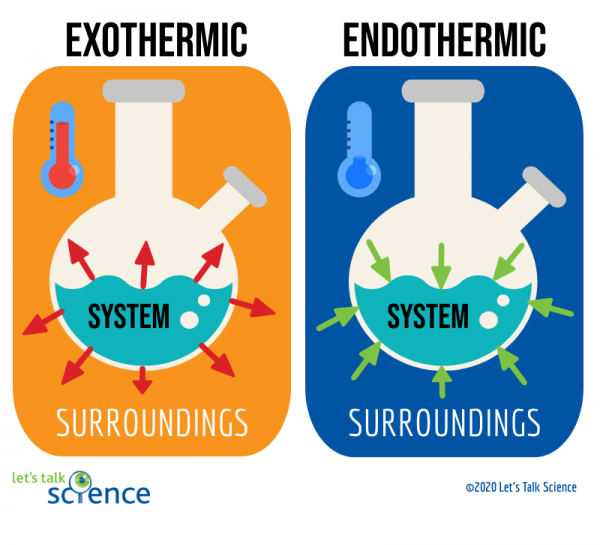
Un modo per farlo è guardando il sistema e l’ambiente circostante di una reazione., Il sistema è dove avviene la reazione e l’ambiente circostante è l’area attorno al sistema.
Per determinare se una reazione è esotermica o endotermica, è possibile:
- misurare la variazione di temperatura del sistema o dei suoi dintorni, oppure
- calcolare l’energia del sistema.
Di questi due metodi, misurare il cambiamento di temperatura è più facile. Per fare ciò, è sufficiente misurare la temperatura di una reazione prima e dopo che è stata completata., Poiché a volte può essere difficile misurare la temperatura all’interno del sistema di una reazione, gli scienziati spesso misurano invece la temperatura dell’ambiente circostante.
È possibile prevedere se una reazione sarà endotermica o esotermica facendo un po ‘ di matematica. Per questo, aiuta a conoscere un po ‘ di reazioni chimiche e legami chimici.,
Ci sono due lati di qualsiasi reazione chimica. Da un lato ci sono i reagenti. Un reagente è la sostanza (o le sostanze) con cui inizi. Dall’altra parte ci sono i prodotti. Un prodotto è la sostanza, o sostanze, che si finisce con dopo la reazione avviene.
In una reazione chimica, i legami chimici nelle molecole reagenti sono rotti. Nuovi legami si formano nelle molecole del prodotto. Un esempio potrebbe essere la reazione di combustione tra metano (CH4) ossigeno (O2) (i reagenti) che produce anidride carbonica (CO2) e molecole di acqua (H20) (i prodotti)., I legami sono rotti nelle molecole di metano e ossigeno. I legami si formano nell’anidride carbonica e nelle molecole d’acqua.
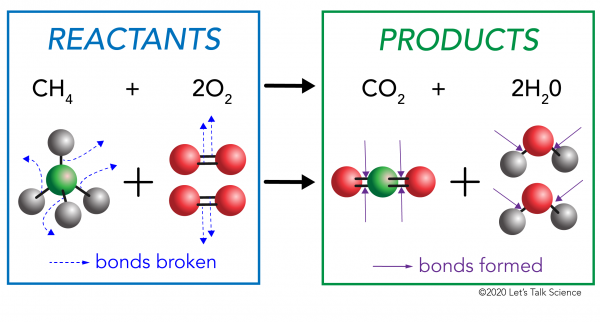
Ciò che è importante sapere è che l’energia è necessaria sia per creare che per rompere i legami., Per determinare se una reazione è esotermica o endotermica, è necessario confrontare la quantità di energia necessaria per rompere i legami dei reagenti con la quantità di energia rilasciata quando vengono creati nuovi legami. Se la quantità di energia rilasciata quando i nuovi legami si formano nei prodotti è maggiore, allora è una reazione esotermica. Se la quantità di energia necessaria per rompere i legami dei reagenti è maggiore, allora è una reazione endotermica.
Un modo per mostrare questo sta usando un diagramma di energia. I diagrammi di energia mostrano i livelli di energia dei reagenti e dei prodotti in una reazione.,
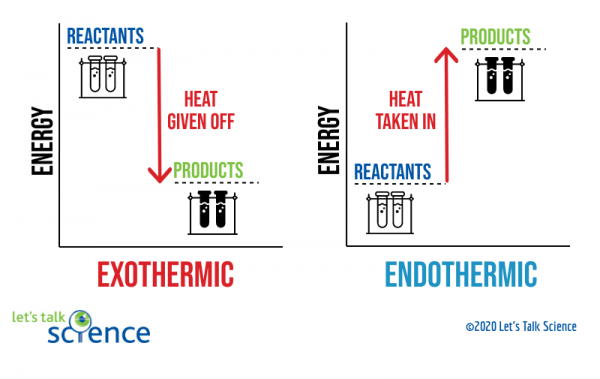
Si può vedere dal diagramma sopra che il livello di energia dei prodotti di una reazione esotermica è inferiore al livello di energia dei reagenti. La differenza tra i livelli di energia dei reagenti e dei prodotti è chiamata variazione entalpica (ΔH). In una reazione esotermica, il ΔH è NEGATIVO. In una reazione endotermica, il ΔH è POSITIVO.,
Lo sapevi?
Gli scienziati possono misurare l’energia negli alimenti misurando la quantità di calore che il cibo rilascia quando viene bruciato. Misurano questo usando uno strumento chiamato calorimetro bomba.
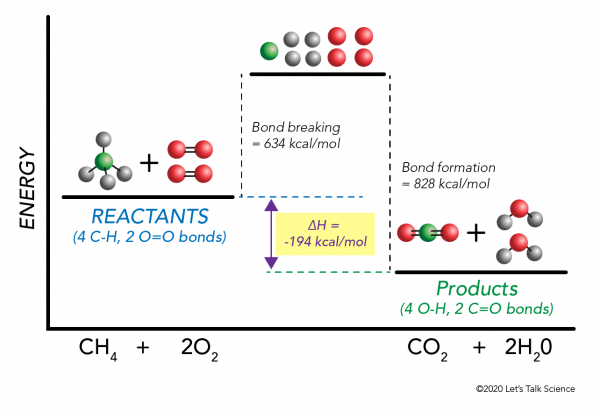
È possibile calcolare ΔH senza nemmeno fare un esperimento! Gli scienziati hanno determinato sperimentalmente le energie necessarie per creare e rompere specifici legami molecolari. Queste energie sono conosciute come energie di legame medio.,r>
Tramite la combustione di metano esempio di nuovo, la matematica funziona in questo modo:
ΔH = –
= –
= –
= –
= 634 – 828
= – 194 kcal/mol
Dal momento che la variazione di entalpia è negativo, sappiamo che la reazione è esotermica.,
Come funziona la termodinamica in un impacco freddo?
Ora, torniamo al nostro impacco freddo istantaneo. Un impacco freddo istantaneo è l’esempio perfetto di una reazione endotermica. Ci sono molti ingredienti possibili in un impacco freddo istantaneo, ma spesso contengono nitrato di ammonio solido e acqua.
Lo sapevi?,
Il nitrato di ammonio è un sale di nitrato. È molto usato in agricoltura come fertilizzante. Viene anche usato come esplosivo nell’industria mineraria.
Il nitrato di ammonio viene conservato in un sacchetto di plastica sigillato circondato da acqua. Quando si apre la borsa, il nitrato di ammonio entra in contatto con l’acqua e si dissolve.
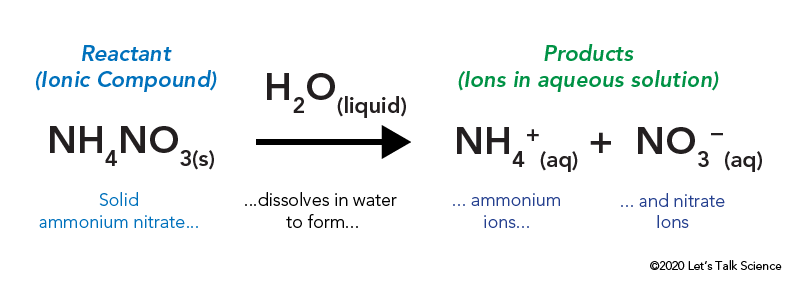
La dissoluzione di un composto ionico, come il sale da cucina o il nitrato di ammonio, comporta energia. Come altri tipi di reazioni, l’energia termica può essere emessa o assorbita quando il materiale si dissolve. Questa energia è chiamata energia della soluzione e può essere scritta come ΔHsoln.
ΔHsoln = Δ ΔH – ∑ΔH
Piuttosto che elaborare il ΔH per i reagenti e i prodotti usando energie di legame, gli scienziati usano spesso valori precalcolati su tabelle standard di entalpia di formazione (ΔH°f)., From such a table we learn that:
| ΔH°f | kJ/mol |
|---|---|
| NH4+(aq) | -132.8 |
| NH4NO3(s) | -365.1 |
| NO3-(aq) | -206.,6 |
facciamo la matematica per calcolare l’energia di soluzione
ΔHsoln = ∑ΔH – ∑ΔH
= –
= –
= – 339.4 + 365.1
= 25.7 kJ
Ricordate all’inizio abbiamo detto che se ΔH è NEGATIVA la reazione è esotermica e che se ΔH è POSITIVA la reazione è endotermica? Bene, questo vale anche per l’energia dei problemi di soluzione. Poiché abbiamo calcolato che il ΔHsoln era positivo (25,7 kJ), la reazione deve essere endotermica. Sappiamo che questo è vero perché il pacchetto freddo ha reso l’ambiente molto freddo!,
Riassumendo…
Le reazioni esotermiche ed endotermiche sono importanti per il nostro mondo chimico. Queste reazioni possono aiutarci a tenerci caldi emettendo energia (esotermica) o aiutarci a raffreddarci assorbendo energia (endotermica).
