硝酸鉛
| 此條目需要補充更多來源。 (2016年10月1日) |
| 硝酸鉛 | |||
|---|---|---|---|

| |||

| |||
| |||
| IUPAC名 硝酸鉛(II) Lead(II) nitrate | |||
| 別名 | Lead nitrate Plumbous nitrate Lead dinitrate Plumb dulcis | ||
| 識別 | |||
| CAS號 | 10099-74-8 | ||
| PubChem | 16683880 | ||
| ChemSpider | 23300 | ||
| SMILES |
| ||
| InChI |
| ||
| UN編號 | 1469 | ||
| ChEBI | 37187 | ||
| RTECS | OG2100000 | ||
| 性質 | |||
| 化學式 | Pb(NO3)2 | ||
| 莫耳質量 | 331.2 g·mol⁻¹ | ||
| 外觀 | 白色固體 | ||
| 密度 | 4.53 g/cm3 (20℃) | ||
| 熔點 | 470℃ 分解[1][2] | ||
| 溶解性(水) | 52 g/100 mL (20 °C) 127 g/100 mL (100℃) | ||
| 溶解性(硝酸 溶於乙醇 溶於甲醇) |
不可溶 0.04 g/100 mL 1.3 g/100 mL | ||
| 折光度n D |
1.782[3] | ||
| 結構 | |||
| 晶體結構 | 面心立方 | ||
| 配位幾何 | 立方八面體 | ||
| 危險性 | |||
| 歐盟危險性符號 | |||
| 警示術語 | R:R61, R20/22, R33, R62, R50/53 | ||
| 安全術語 | S:S53, S45, S60, S61 | ||
| MSDS | ICSC 1000 | ||
| 歐盟編號 | 082-001-00-6 | ||
| NFPA 704 | |||
| 閃點 | 不可燃 | ||
| 相關物質 | |||
| 其他陰離子 | 硫酸鉛 氯化鉛 溴化鉛 | ||
| 其他陽離子 | 硝酸錫 | ||
| 相關化學品 | 硝酸鉍 硝酸鉈 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
硝酸鉛,IUPAC中文名稱為硝酸鉛(II),是鉛的硝酸鹽,通常呈無色晶體或白色的粉末。與其它二價鉛鹽不同,硝酸鉛溶於水。通常將金屬鉛或氧化鉛與硝酸反應製得硝酸鉛,再進一步合成其它鉛化合物。
在歷史上,硝酸鉛是從中世紀以Plumb dulcis的名字為人們所認識的[4],那時從金屬鉛或氧化鉛通過硝酸製備硝酸鉛的生產都是小規模的。到19世紀時硝酸鉛在歐洲和美國就被商業化生產,當時主要是用做製造顏料的主要原料,但是因為有毒,所以逐漸被毒性較低的二氧化鈦取代。其它工業用途是作為熱穩定劑在尼龍、聚酯和熱成像紙塗料中使用。大約自2000年左右,硝酸鉛已開始被用於氰化物鍊金法。
硝酸鉛具有毒性,是一種氧化劑,被國際癌症研究機構列為2A類致癌物。因此,它必須以適當的安全措施處理和保存,以防止吸入、誤食和皮膚接觸。因為它的危險性,硝酸鉛的應用限制還在持續審議中。
歷史[編輯]
從中世紀起,硝酸鉛就作為原料用於含鉛顏料像是鉻黃(鉻酸鉛)、鉻橙(鉻酸鉛跟氧化鉛混合物)以及相關鉛化合物的生產。這些顏料被用於印花布等紡織品的染色。[5]
1597年,德國鍊金術士安德烈亞斯·利巴菲烏斯首次對硝酸鉛做了描述,以plumb dulcis和calx plumb dulcis的名字來命名它,字面意思是"甜蜜的鉛",取自硝酸鉛嘗起來的味道。[6]雖然最初對此物質的其它性質還不太了解,但在接下來的幾個世紀中,人們根據硝酸鉛燃燒時會發出燒爆聲(decrepitation)的性質,把他運用在火柴和特殊炸藥的合成上,例如用硝酸鉛和疊氮化鈉合成疊氮化鉛。[7]
歷史上,生產硝酸鉛的過程是簡單的化學反應。一般是將鉛放入濃硝酸中溶解,隨後的沉澱物便是硝酸鉛。不過,即使生產方法簡單,小規模生產仍然持續了許多世紀,而硝酸鉛(II)作為製造其它鉛化合物原料的商業化生產,到1835年後才有文獻記載。[8][9]在1974年,美國的鉛化合物,不含色素和汽油添加物,消費量為642噸。[10]
晶體結構[編輯]
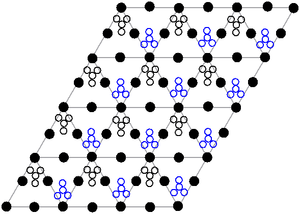
硝酸鉛的晶體結構已經由中子衍射測定出來。[11][12]其中的鉛原子以立方晶系中面心立方的方式堆積。它的空間群是Pa3Z=4(布拉菲晶格表示法),每個晶胞的邊長784pm。
在此圖中的黑點代表鉛原子,白點代表比鉛原子平面高27pm的硝酸根離子,而藍色點則代表比鉛原子平面低27pm的硝酸根離子。在這個狀態下每個鉛原子皆與12個氧原子產生鍵結,且晶體中全部N–O鍵的鍵長皆一樣,均為127pm。[13]
之前會對硝酸鉛的晶體結構有興趣而去研究它,有一部分的原因是基於晶格內部的硝酸根離子在高溫時有可能可以自由的旋轉,但此預測最後並沒有被證實[12]。
製備[編輯]
硝酸鉛不存在於自然界中,它可用硝酸溶液溶解金屬鉛的方法製備:[10]
- 3 Pb (s) + 8 H+ (aq) + 2 NO-
3 (aq) → 3 Pb2+ (aq) + 2 NO↑ (g) + 4 H2O (l)
另一種更常見的方法是把氧化鉛溶解在硝酸溶液當中,這是一種快速處理方鉛礦礦石的方法:[10]
- PbO (s) + 2 H+ (aq) → Pb2+ (aq) + H2O (l)
相反,鉛在濃硝酸中反應,會形成難溶於濃硝酸的無水硝酸鉛,難溶的原因是發生了同離子效應。[14]
- Pb2+ (aq) + 2 NO-
3 (aq) → Pb(NO3)2 (s)
大部分市售的硝酸鉛和實驗室規模的材料,都是根據相應的方法生產的。[15]以25kg一袋至1000kg一袋的形式包裝在用於盛放中間體的柔性散裝容器(Flexible intermediate bulk container)或實驗室容器中的。還沒有更大重量規格的產品報導。[來源請求]
用硝酸處理含鉛廢棄物,比如煉鉛廠處理鉛-鉍廢棄物時,副產物是不純的硝酸鉛溶液。這些溶液據報導可用於氰化物鍊金法(gold cyanidation process)[16]。
化學性質[編輯]
除了醋酸鉛外,硝酸鉛是唯一一種可溶於水的鉛化合物,硝酸鉛可迅速溶於水形成透明的無色溶液[17][已過時],所以常以硝酸鉛通過水溶液複分解反應合成其它鉛化合物,比如它的水溶液與碘化鉀產生化學作用,生成橙黃色的沉澱物碘化鉛。
作為離子化合物,溶解後的硝酸鉛解離成相應的離子:
- Pb(NO3)2 (s) → Pb2+ (aq) + 2 NO-
3 (aq)
20%的硝酸鉛水溶液為pH值在3.0至4.0之間的微酸性溶液[18]。
當硝酸鉛水溶液中加入濃的氫氧化鈉,即使是加入的氫氧化鈉量超過等當量點(equivalence point),都會形成硝酸鉛的鹼式鹽。在氫氧化鈉的量未超過等當量點的一半時,形成的主要是Pb(NO3)2·Pb(OH)2;超過等當量點的一半之後形成的是Pb(NO3)2·5Pb(OH)2。即使溶液的pH值高達到12也不會形成單純的 Pb(OH)2。[19][20]
由硝酸鉛形成的絡合物[編輯]
由於鉛離子可以與含有配位性氮和氧原子的化合物配位,使得硝酸鉛在超分子化學方面有使人感興趣的性質。雖然這種興趣大部分都是學術上的,但它也有幾種潛在的應用可能。比如將硝酸鉛和二甘醇(EO5)在乙腈和甲醇的混合物溶液中混合配位後,緩慢蒸發溶劑可產生一種新的晶體材料Pb(NO3)2(EO5)][21]。在這種化合物的晶體結構中,二甘醇分子鏈會在水平面方向上像冠醚一樣圍繞在鉛離子的周圍,兩個單齒的硝酸根配體呈反式構型,鉛離子的總配位數為10,以鉛離子為中心的配合物分子結構為四方反稜柱。[來源請求]
由硝酸鉛、高氯酸鉛和含氮雙齒配體2,2'-聯噻唑合成出的雙核配合物[Pb2(C6H4N2S2)4(NO3)(H2O)](ClO4)3,其配合物分子結構中硝酸根作為橋聯配體的形式連接起兩個配位數分別是5和6的鉛離子[22]。這類配合物一個有趣的性質在於兩個中心原子周圍的配位層(coordination sphere)在物理性質上有差異,比如配體沒有對稱地放置在金屬離子周圍。這可能是鉛離子所帶有的一對孤對電子造成的。在奈米尺寸的三足配體2,4,6-三[4-(咪唑-1-基甲基)苯基]-1,3,5-三嗪(timpt)與鉛離子形成的配合物[Pb(timpt)(NO3)2]·(Et2O)0.417·(H2O)0.167中也發現了這種現象[23]。
這種化學性質不是硝酸鉛獨有的,其它的二價鉛化合物比如PbBr2也能形成類似的配合物,但是因為硝酸根的溶解性和它所具有的雙齒配位的性質,使硝酸鉛被常用於合成這類雙核配合物。[來源請求]
氧化和燒爆作用[編輯]
硝酸鉛是一種氧化劑。根據反應的不同,起到氧化作用的既可以是二價鉛離子也可以是硝酸根離子。水溶液中鉛離子的標準還原電勢(E0)為-0.125V,可在中性的水溶液中起到氧化作用;硝酸根離子在酸性水溶液中的標準還原電勢為+0.956V[24],能在酸性溶液或高溫條件下起到氧化作用。
當硝酸鉛加熱時,會分解成氧化鉛、氧氣和二氧化氮,同時發出爆烈的聲響,這個效果被稱為燒爆作用。化學式如下:[25]
應用[編輯]
鑑於硝酸鉛的危險性,在工業生產的應用上都傾向於使用硝酸鉛的替代品。含鉛塗料是過去硝酸鉛的主要用途,先已被二氧化鈦所代替[26]。
歷史上其它一些硝酸鉛的用途比如火柴和煙火,都已經削減或停止使用硝酸鉛。[來源請求]
硝酸鉛目前的用途包括滅鼠劑、尼龍和聚酯材料及光敏熱成像紙塗料的熱穩定劑。[10]
在實驗室中,硝酸鉛是兩種方便可靠的二氧化氮的來源之一。先將硝酸鉛小心乾燥後在鋼製容器中加熱,二氧化氮就隨著氧氣一起生成。另一種實驗室製備二氧化氮的方法是將濃硝酸與銅屑反應製備,但在反應過程中隨著硝酸濃度的降低生成的二氧化氮中會混有一氧化氮。這兩種實驗室合成二氧化氮的方法制出的二氧化氮中均混有二氧化氮的二聚體四氧化二氮。
- 2 NO2 ⇌ N2O4
通過壓縮和分餾能除去雜質得到NO2和N2O4的混合物[10]。由於二氧化氮的二聚是放熱反應,所以低溫下二氧化氮主要以二聚體的形式存在。[來源請求]
為了改善氰化物鍊金法,需要在槽罐浸出(Tank leaching)的過程中加入硝酸鉛。儘管這是一個看似龐大的過程,但是只用到少量的硝酸鉛(每千克黃金僅需10到100毫克的硝酸鉛)。[27][28]由於氰化法所用的硝酸鉛和氰化物本身具有毒性,該方法被認為是有爭議的,會帶來環境上的污染。
在有機化學上,硝酸鉛可用作氧化劑,比如作為Sommelet反應的氧化劑,將苄基鹵代烴氧化成苯甲醛[29]。硝酸鉛也可用於將二硫代氨基甲酸酯轉變為異硫氰酸酯同時形成硫化鉛沉澱[30]。鑑於硝酸鉛自身的毒性,大部分情況下已不再傾向於使用它,但偶爾仍會用到,比如在SN1取代反應中起到類似於硝酸銀的作用,通過形成溴化鉛沉澱用它來奪取溴原子[31]。


安全性[編輯]
硝酸鉛有毒,誤服會導致鉛中毒,症狀包括腸胃不適、嚴重腹痛、無胃口、反胃、嘔吐、抽筋,長時期攝取會損害神經系統和腎臟。鉛毒會累積體內,逾90%會停留在骨組織,要經過數年才能逐步排出。[來源請求]
兒童的消化系統比成年人更容易吸收鉛,所以危害也更大。懷孕期間攝取會增加流產、胎兒發育不健全和腦部受損的機會。不少國家已立法保障兒童和孕婦避免接觸鉛和其化合物。[32]
鉛的無機化合物被國際癌症研究機構(IARC)列為可能致癌(2A類致癌物)[33]。鉛被認為與動物實驗中的腎癌和膠質瘤,以及人類的腎癌、腦癌和肺癌有關。然而,曝露於鉛之下的工人因常同時接觸砷,使真正成因的研究變得較為複雜。[34]鉛也會取代部分酶中的鋅,包括涉及血紅素生物合成過程的膽色素原合酶(也稱δ氨基-γ-酮戊酸脫氫酶,porphobilinogen synthase)、對於DNA的正常代謝非常重要的核苷酸酶(Nucleotidase),影響它們正常的生物功能。[來源請求]
注意事項[編輯]
以含鉛量計,美國勞工部下屬的美國職業安全衛生管理局規定的允許暴露限度為:50μg/m3[1],美國職業安全衛生管理局規定的干預水平:30μg/m3 [1],美國政府工業衛生學家會議提出的閥極限值為:0.05g/m3 [1]。
實驗室中硝酸鉛應遠離還原劑放置,單獨存放在陰涼乾燥且通風良好的固定位置[1]。處理硝酸鉛時需要使用保護措施,包括保護眼鏡、面罩、膠手套等。硝酸鉛的實驗應在通風櫃中進行,實驗產生的廢棄物要特別處理[2]。
毒理學和生態學性質以及化學品危險特性:
- 動物的毒理學性質:半數致死濃度LC50和半數致死量LD50暫無[2]
- 水生態毒性:對於食蚊魚在48小時內的半數致死濃度LD50為240ppm,對水蚤在96小時的半數致死濃度LD50為6.7ppm。[2]。
- 危險特性:
| 總體毒性 | 可燃性 | 對皮膚和眼睛的破壞性 | 是否被皮膚吸收 | 是否為致敏物 | 自身是否反應 |
| 3[1] | 0[1] | 1[1] | 否[1] | 否[1] | 否[1] |
其他[編輯]
參考資料[編輯]
- ^ 1.00 1.01 1.02 1.03 1.04 1.05 1.06 1.07 1.08 1.09 1.10 1.11 Jay A. Young. Lead(II) Nitrate. J. Chem. Educ. 2004, 81 (12): 1709 [2012-08-30]. doi:10.1021/ed081p1709. (原始內容存檔於2019-06-18).(英文)
- ^ 2.0 2.1 2.2 2.3 Material Safety Data Sheet Lead nitrate MSDS (PDF). [2012-08-30]. (原始內容存檔於2012-09-16).
- ^ Patnaik, Pradyot. Handbook of Inorganic Chemical Compounds. McGraw-Hill. 2003: 475 [2009-06-06]. ISBN 0-07-049439-8.(英文)
- ^ Jonah Falcon. The REAL facts about Lead Nitrate. Thu, 08 Mar 2007 19:48:45 GMT [2012-02-28]. (原始內容存檔於2008-06-09). (英文)
- ^ Partington, James Riddick. A Text-book of Inorganic Chemistry. MacMillan. 1950: 838.(英文)
- ^ Libavius, Andreas. Alchemia Andreæ Libavii. Francofurti: Iohannes Saurius. 1595.(英文)
- ^ 7.0 7.1 Barkley, J.B. Lead nitrate as an oxidizer in blackpowder. Pyrotechnica (Post Falls, ID: Pyrotechnica Publications). October 1978, IV: 16–18.(英文)
- ^ Lead. Encyclopedia Britannica Eleventh Edition. [2006-10-11]. (原始內容存檔於2006-10-05).(英文)
- ^ Macgregor, John. Progress of America to year 1846. London: Whittaker & Co. 1847. ISBN 0-665-51791-2.(英文)
- ^ 10.0 10.1 10.2 10.3 10.4 Greenwood, Norman N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford: Butterworth-Heinemann. 1997: 388, 456. ISBN 0-7506-3365-4. (英文)
- ^ Hamilton, W.C. A neutron crystallographic study of lead nitrate. Acta Cryst. 1957, 10: 103–107. doi:10.1107/S0365110X57000304.(英文)
- ^ 12.0 12.1 Nowotny, H.; G. Heger. Structure refinement of lead nitrate (PDF). Acta Cryst.C. 1986, 42: p133–135. doi:10.1107/S0108270186097032. (英文)
- ^ Cấu trúc của chì nitrat. [15 July 2019]. (原始內容存檔於2021-12-20).
- ^ Adlam, G.H.J.; Price, L.S. Higher School Certificate Inorganic Chemistry. 1945. (英文)
- ^ Adlam, George Henry Joseph; Price, Leslie Slater. A Higher School Certificate Inorganic Chemistry. London: John Murray. 1938. (英文)
- ^ Product catalog; other products. Tilly, Belgium: Sidech. [2008-01-05]. (原始內容存檔於2007-07-01).(英文)
- ^ Ferris, L.M. Lead nitrate—Nitric acid—Water system (PDF). Journal of Chemicals and Engineering Date (Oak Ridge National Laboratory). December 1959 [2006-10-11]. (原始內容 (PDF)存檔於2007-09-29).(英文)
- ^ http://www.mallbaker.com/americas/msds/english/L3130_msds_us_Default.pdf[失效連結]
- ^ Othmer, D.F. Kirk-Othmer Encyclopedia of Chemical Technology. 12 (Iron to Manganese) second completely revised. New York: John Wiley & Sons. 1967: 272. ISBN 0-471-02040-0.(英文)
- ^ Pauley, J. L.; M. K. Testerman. Basic Salts of Lead Nitrate Formed in Aqueous Media. Journal of the American Chemical Society. 1954, 76 (16): 4220–4222. doi:10.1021/ja01645a062. (英文)
- ^ Rogers, Robin D.; Andrew H. Bond, and Debra M. Roden. Structural Chemistry of Poly (ethylene glycol). Complexes of Lead(II) Nitrate and Lead(II) Bromide. Inorg. Chem. 1996, 35 (24): 6964–6973. PMID 11666874. doi:10.1021/ic960587b. (英文)
- ^ Mahjoub, Ali Reza; Ali Morsali. A Dimeric Mixed-Anions Lead(II) Complex: Synthesis and Structural Characterization of [Pb2(BTZ)4(NO3)(H2O)](ClO4)3 {BTZ = 4,4'-Bithiazole}. Chemistry Letters. 2001, 30 (12): 1234. doi:10.1246/cl.2001.1234. (英文)
- ^ Wan, Shuang-Yi; Jian Fan, Taka-aki Okamura, Hui-Fang Zhu, Xing-Mei Ouyang, Wei-Yin Sun and Norikazu Ueyama. 2D 4.8² Network with threefold parallel interpenetration from nanometre-sized tripodal ligand and lead(II) nitrate. Chem. Commun. 2002, (21): 2520–2521 [2012-08-28]. doi:10.1039/b207568g. (原始內容存檔於2012-11-14). (英文)
- ^ Hill, John W.; Petrucci, Ralph H. General Chemistry 2nd. Upper Saddle River, New Jersey: Prentice Hall. 1999: 781. ISBN 0-13-010318-7. (英文)
- ^ Ramakrishna, A. Goyal’s IIT FOUNDATION COURSE CHEMISTRY: For Class-9. Goyal Brothers Prakashan. 2014-03-07: p. 25. ISBN 9788183894760 (英語).
- ^ Historical development of titanium dioxide. Millennium Inorganic Chemicals. [2008-01-04]. (原始內容存檔於2007-10-21).(英文)
- ^ Habashi, Fathi. Recent advances in gold metallurgy. Quebec City, Canada: Laval University. 1998 (est) [2008-01-05]. (原始內容存檔於2008-03-30).
- ^ Auxiliary agents in gold cyanidation. Gold Prospecting and Gold Mining. [2008-01-05]. (原始內容存檔於2012-04-23).(英文)
- ^ Schulze, K. E. Über α- und β-Methylnaphtalin. Chemische Berichte. 1884, 17: 1530. doi:10.1002/cber.188401701384.(德文)
- ^ 30.0 30.1 Dains, F. B.; Brewster, R. Q.; Olander, C. P.. "Phenyl isothiocyanate". Org. Synth.; Coll. Vol. 1: 447. (英文)
- ^ Rapoport, H.; Jamison, T. (1998). "(S)-N-(9-Phenylfluoren-9-yl)alanine and (S)-Dimethyl-N-(9-phenylfluoren-9-yl)aspartate". Org. Synth.; Coll. Vol. 9: 344. (英文)
- ^ 例如法國: Art. R234-20, Code du travail[失效連結](法文)
- ^ Inorganic and Organic Lead Compounds (PDF). IARC Monographs on the Evaluation of Carcinogenic Risks to Humans (International Agency for Research on Cancer). 1987,. Suppl. 7: 239 [2008-01-19]. (原始內容存檔 (PDF)於2011-08-22).(英文)
- ^ Monographs on the Evaluation of Carcinogenic Risks to Humans: Inorganic and organic lead compounds 87. IARC. 2004-02-10 [2006-11-02]. (原始內容存檔於2006-11-23).(英文)
外部連結[編輯]
- 鉛礦年報,金屬與礦產,1981第一期 (頁面存檔備份,存於網際網路檔案館)
- International Chemical Safety Card 1000(頁面存檔備份,存於網際網路檔案館)
- IARC Monograph: "Lead and Lead Compounds"PDF (0.99 MB)
- Draft IARC Monograph: "Inorganic and Organic Lead Compounds"PDF (49.6 KB)
- NIOSH Pocket Guide to Chemical Hazards (頁面存檔備份,存於網際網路檔案館)
- National Pollutant Inventory - Lead and Lead Compounds Fact Sheet
- Lead Poisoning Prevention Information (頁面存檔備份,存於網際網路檔案館)
- 物質安全資料表(MSDS)
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||





