Gas perfetti: spiegazione, formule, esempi
Equazione di stato dei gas perfetti: spiegazione della Legge di Boyle-Mariotte, della prima e seconda legge di Gay-Lussac
EQUAZIONE DI STATO DEI GAS PERFETTI
Lo stato di un gas è sempre definito, a livello macroscopico, da un ben determinato valore della temperatura, del volume e della pressione. Ogni volta che una di queste grandezze muta, si opera una trasformazione dello stato del gas. Queste trasformazioni possono essere di tre tipi:
- isotermiche, che avvengono cioè a temperatura costante
- isobariche, che avvengono a pressione costante
- isometriche (o isocore), che avvengono a volume costante.
Un gas ideale (o gas perfetto) è un modello ideale di gas per cui valgono le seguenti tre leggi che sono valide in base al tipo di trasformazione:
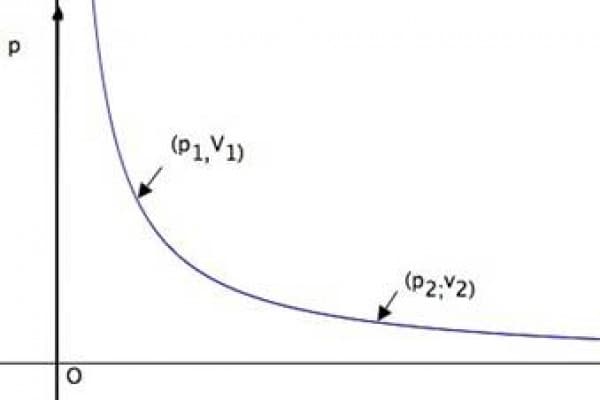
1) La legge di Boyle-Mariotte descrive i cambiamenti di stato che avvengono a temperatura costante. In questo caso un aumento della pressione (o del volume ) produce una corrispondente diminuzione del volume (o della pressione) secondo la seguente legge: p1V1 = p2V2 dove con p1 e V1 si indicano la pressione e il volume del gas prima della variazione (di pressione o di volume) e con p2eV 2 il loro stato finale.
La precedente relazione può essere rappresentata in un piano cartesiano in cui sono presenti nell’ascissa il volume e in ordinata la pressione (la temperatura non compare poiché in questo tipo di trasformazione resta costante).
La curva disegnata nel grafico, dal punto di vista matematico è una iperbole. I grafici delle trasformazioni isoterma si rappresenteranno sempre con una iperbole che cambierà le sue caratteristiche in base alla temperatura.

2) La prima legge di Gay-Lussac o Legge di Charles descrive i cambiamenti di stato che avvengono a pressione costante (trasformazioni isobare) e può essere espressa mediante la seguente relazione (già introdotta nella sezione dedicata alla dilatazione dei gas):
V = V0 (1+aT);
dove con V si intende il volume finale, con V0 quello iniziale, con T la temperatura e con a la costante tipica dei gas.
3) La seconda legge di Gay-Lussac si applica, invece, nel caso di trasformazioni a volume costante (isometriche). In questo caso il cambiamento di temperatura provoca un cambiamento di pressione corrispondente pari a:
p = p0 (1+aT);
dove con p si intende la pressione finale, con p0 quella iniziale, con T la temperatura e con a la costante tipica dei gas richiamata precedentemente.
Un gas per il quale leggi sono verificate è un gas perfetto. Per questo tipo di gas è verificata anche l’equazione dei gas perfetti che racchiude in sé le precedenti leggi:
pV=nRT in cui:
- p indica il valore della pressione del gas;
- V il volume occupato dal gas;
- n è il numero di moli del gas;
- R è la costante universale dei gas, il cui valore è funzione delle unità di misura adottate per esprimere le altre grandezze nell'equazione;
- T è la temperatura assoluta del gas, generalmente espressa in kelvin.
Il valore di R nel Sistema Internazionale è 8,314472 J/(mol·K); nei calcoli si utilizza spesso anche il valore di 0,0821 l·atm/(mol·K).
La stessa legge è espressa a volte anche nel seguente modo: pV=NkT.
In questo caso con N sono il numero di molecole, T la temperatura e k è una costante (chiamata costante di Boltzmann in onore del fisico austriaco L. Boltzmann (18844-1906) che ha introdotto questa quantità).
La costante k è una delle costanti fondamentali della natura che si utilizza in molte altre relazioni della fisica.
Domanda tipica: “Come puoi mettere in relazione R e k?” Per rispondere a questa domanda è necessario ricordare la definizione della grandezza mole data in chimica: una mole è la quantità di sostanza che contiene tante “entità elementari” (ovvero atomi o molecole) quante ce ne sono in 12 g di carbonio-12.
Il numero di queste “entità elementari” è indicato con il numero di Avogadro (in onore del fisico italiano Amedeo Avogadro (1776-1856)) ed è pari a:
NA=6.022*1023molecole/mol.
Partendo quindi dalle due relazioni, pV=nRT e pV=NkT, ed uguagliando entrambi i secondi membri delle relazioni si ha:
nRT=NkT.
Semplificando, infine, T in entrambe le relazioni si ottiene: nR=Nk.
LEGGE DEI GAS PERFETTI: EQUAZIONE E SPIEGAZIONE
La legge dei gas perfetti, a differenza delle precedenti, è sempre valida in qualunque condizione mentre le altre erano valide solo in casi particolari (a pressione costante o a volume costante per esempio).
Come già osservato, questa equazione rappresenta una generalizzazione delle leggi empiriche osservate da Boyle, da Gay-Lussac e Charles ottenibili rispettivamente ponendo T = costante, p = costante e V = costante.
L'equazione di stato dei gas perfetti descrive bene il comportamento dei gas reali per pressioni non troppo elevate e per temperature non troppo vicine alla temperatura di liquefazione del gas. In questi casi, una migliore descrizione del comportamento del gas è dato dall'equazione di stato di Van der Waals.
Di un gas ideale si possono indicare le proprietà dal punto di vista microscopico e si trova che possiede le seguenti caratteristiche:
1. le molecole sono puntiformi;
2. interagiscono tra loro e con le pareti del recipiente mediante urti elastici;
3. non esistono forze di interazione a distanza tra le molecole del gas;
4. l'energia cinetica media delle molecole del gas è direttamente proporzionale alla temperatura.
I gas reali sono descritti dalla legge dei gas perfetti con buona approssimazione solo quando la pressione è sufficientemente bassa e la temperatura sufficientemente alta.
L'equazione di stato dei gas perfetti, nota anche come legge dei gas perfetti, descrive le condizioni fisiche di un "gas perfetto" o di un gas "ideale", correlandone le funzioni di stato: quantità di sostanza, pressione, volume e temperatura.
L'IMPORTANZA DEI MODELLI IN FISICA
Nella fisica i modelli sono fondamentali. Da un certo punto di vista si può dire che la fisica (ma in generale tutte le scienze) descrivono la realtà attraverso una modellizzazione che molto spesso consiste in una semplificazione che permette di spiegare alcune caratteristiche di un processo troppo complesso da spiegare senza di esse.
Nell'uso scientifico e tecnico, un modello è una rappresentazione di un oggetto o di un fenomeno, che corrisponde alla cosa modellata per il fatto di riprodurne (eventualmente alla luce di una certa interpretazione) alcune caratteristiche o comportamenti fondamentali, in modo tale che questi aspetti possano essere mostrati, studiati, conosciuti laddove l'oggetto modellato non sia accessibile.
TEMPERATURA ASSOLUTA
Sperimentalmente si è osservato che esiste una temperatura al di sotto della quale non è possibile raffreddare un corpo. Se, infatti, si prendono diversi gas, essi hanno differenti pressioni a ogni data temperatura. Tuttavia se si raffreddano si osserva che tendono tutti alla stessa temperatura (precisamente a -273.15 °C) quando la pressione tende a zero.
Questa temperatura si chiama zero assoluto. Questo zero assoluto è ovviamente ben diverso dallo 0°C che spesso si misura nelle giornate invernali. Lo zero assoluto è stato preso come riferimento per impostare la scala (chiamata per questo motivo “scala di temperatura assoluta”) che è già stata introdotta nelle pagine relative alla temperatura e ai termometri e coincide con la temperatura di un corpo espressa in Kelvin. La temperatura assoluta è una delle grandezze principali utilizzate nello studio della termodinamica.
Per convertire una temperatura assoluta nella corrispondente (e più comune) temperatura in gradi Celsius basta sottrarvi il valore 273.15K. Questo è possibile poiché 1 grado Kelvin è uguale ad 1 grado Celsius e 0 gradi Celsius sono pari a 273.15 gradi Kelvin. Per esempio 298.15K sono equivalenti a 298.15K – 273.15K = 25°C.
UN AIUTO EXTRA PER IL TUO STUDIO
Dai uno sguardo a questi libri selezionati per te e scopri la fisica da un altro punto di vista:



