Modelo atómico de Rutherford

El modelo atómico de Rutherford o modelo planetario fue creado por Ernest Rutherford en 1911 a partir del llamado “el experimento de la hoja de oro”. Este modelo surgió después del modelo de Thomson. Rutherford fue premio Nobel de Química en 1908.
Si te interesa aprender sobre el modelo atómico de Rutherford, te recomendamos seguir leyendo este artículo de GEOenciclopedia donde verás un resumen sobre su modelo planetario del átomo.
- Qué es el modelo atómico de Rutherford
- El experimento de la hoja de oro
- Conclusiones del experimento de Rutherford
- Principios básicos del modelo atómico de Rutherford
- Aceptación del modelo atómico de Rutherford
- Limitaciones y errores en el modelo de Rutherford
- Consideraciones adicionales del modelo de Rutherford
- Quién fue Ernest Rutherford
Qué es el modelo atómico de Rutherford
Modelo Atómico de Rutherford fue creado por Ernest Rutherford (20 de agosto de 1871 – 19 de octubre de 1937). También es llamado el modelo planetario y fue desarrollado en 1911.
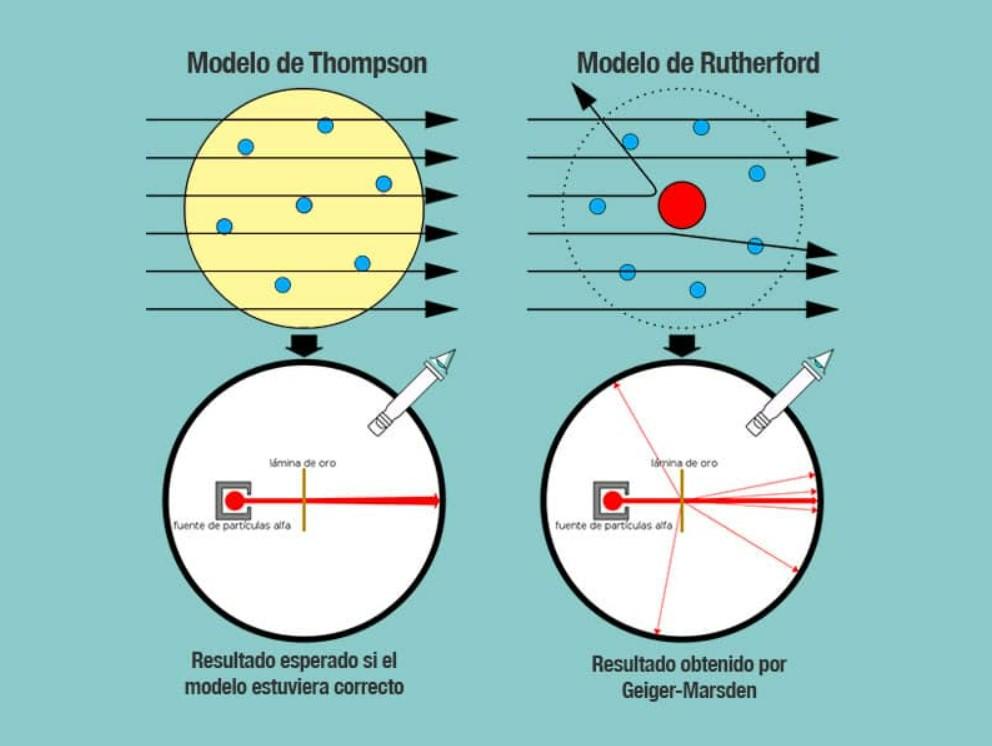
Después del modelo de Thomson que consideraba que los electrones se encontraban en un medio de carga positiva, dos ayudantes de Rutherford, Geiger y Marsden, realizaron en 1909 un estudio conocido como “el experimento de la hoja de oro”, el cual demostró que el modelo del “pudín con pasas” de Thomson estaba equivocado, ya que mostraron que el átomo tenía una estructura con una fuerte carga positiva.
Este experimento, diseñado y supervisado por Rutherford, condujo a conclusiones que terminaron en el modelo atómico de Rutherford presentado en 1911.
El experimento de la hoja de oro
Esta serie de experimentos fueron realizados entre 1909 y 1913 en los laboratorios de física de la Universidad de Manchester por un par de científicos, Hans Geiger y Ernest Marsden, colaboradores de Ernest Rutherford y bajo la supervisión del mismo. La importancia de estos experimentos radica en el hecho que sus resultados y conclusiones condujeron a un nuevo y revolucionario modelo atómico.
El experimento consistía en bombardear con partículas alfa una lamina delgada de oro de 100 nm de espesor. Las partículas alfa eran iones, o sea átomos sin electrones por lo que solamente tenían protones y neutrones y en consecuencia una carga positiva. Si el modelo de Thomson era correcto, las partículas alfa atravesarían los átomos de oro en línea recta.
Para estudiar la deflexión causada a las partículas alfa, colocó un filtro fluorescente de sulfuro de zinc alrededor de la fina lámina de oro donde pudieron observar que aunque algunas partículas atravesaban los átomos de oro en línea recta, pero otras eran desviadas en direcciones aleatorias.

Conclusiones del experimento de Rutherford
Los modelos atómicos anteriores consideraban que la carga positiva estaba distribuida uniformemente en el átomo, lo cual haría fácil atravesarla dado que su carga no sería tan fuerte en un punto determinado.
Los resultados inesperados del experimento, hicieron concluir a Rutherford que el átomo tenía un centro con una fuerte carga positiva que cuando una partícula alfa intentaba pasar era rechazada por esta estructura central.
Considerando la cantidad de partículas reflejadas y las que no lo eran, pudo determinar el tamaño de ese núcleo comparado con la órbita de los electrones a su alrededor y también pudo concluir que la mayor parte del espacio de un átomo está vacío.
Adicionalmente, algunas de las partículas alfa fueron desviadas por la lámina de oro en ángulos muy pequeños, y por lo tanto pudo concluir que la carga positiva en un átomo no está uniformemente distribuida. La carga positiva en un átomo se concentra en un volumen muy pequeño.
Finalmente, como muy pocas de las partículas alfa se desviaron hacia atrás, es decir, como si hubieran rebotado pudo deducir que el volumen ocupado por las partículas cargadas positivamente en un átomo es muy pequeño en comparación con el volumen total de un átomo.
En consecuencia de todos estos interesantes descubrimientos, fue evidente para Rutherford que el modelo atómico como se conocía estaba erróneo, por lo que creó uno nuevo con las siguientes consideraciones.

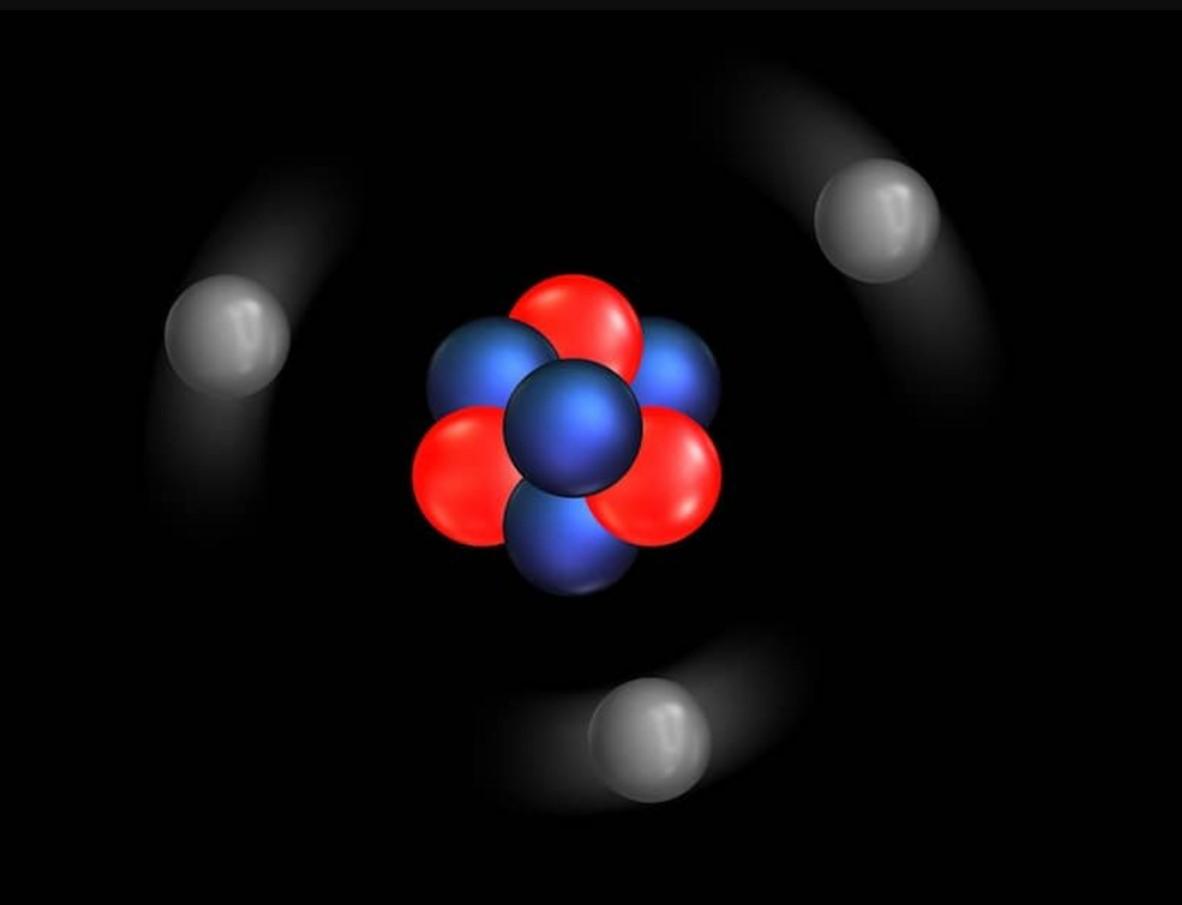
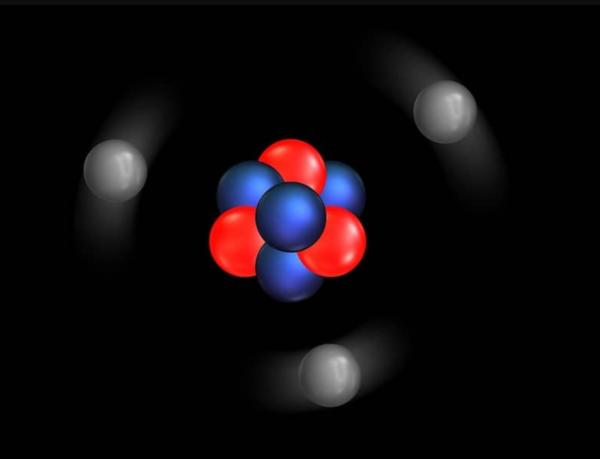
Principios básicos del modelo atómico de Rutherford
- Las partículas con carga positiva se encuentran en un volumen muy pequeño comparado con el tamaño del átomo.
- La mayor parte de la masa del átomo se encuentra en ese pequeño volumen central. Rutherford no lo llamó “núcleo” en sus papales iniciales, pero lo hizo a partir de 1912.
- Los electrones con carga eléctrica negativa giran alrededor del núcleo.
- Los electrones giran a altas velocidades alrededor del núcleo y en trayectorias circulares a las que llamó órbitas.
- Tanto los electrones cargados negativamente como el núcleo con carga positiva se mantienen unidos por una fuerza de atracción electrostática.
Aceptación del modelo atómico de Rutherford
Este modelo tuvo gran aceptación en la comunidad científica y vislumbró un panorama de un átomo con varias partículas subatómicas. Científicos posteriores pudieron determinar el número de electrones o número atómico de cada elemento.
Culturalmente, pese a todos los nuevos descubrimientos, el modelo tipo planetario de Rutherford-Bohr es el que sigue en la mente de la mayoría de la gente y es aún la forma más sencilla de explicar el funcionamiento de un átomo, con un núcleo de protones y neutrones y electrones en órbitas girando alrededor.

Limitaciones y errores en el modelo de Rutherford
Aunque el modelo atómico de Rutherford fue un gran avance en la física, no era perfecto ni completo, de hecho de acuerdo a las leyes de Newton era algo imposible y tampoco explicaba un aspecto importante de las leyes de Maxwell. Este modelo no pudo explicar ciertas cosas como:
- No tenía una explicación de cómo se mantenían unidas un grupo de cargas positivas en el núcleo. Según la teoría eléctrica, las cargas positivas se deberían repeler. Sin embargo, el núcleo era la unión de varios protones.
- Otra contradicción de este modelo fue hacia las leyes fundamentales de la electrodinámica, ya que al considerar que los electrones con carga negativa giran alrededor del núcleo, según las leyes de Maxwell, deberían emitir radiación electromagnética. Esta radiación consumiría energía que haría que los electrones colapsaran con el núcleo. Por lo tanto, no podía explicar la estabilidad del átomo.
Consideraciones adicionales del modelo de Rutherford
Aunque el modelo atómico de Rutherford fue rápidamente sustituido por el modelo de Bohr que resolvía algunos de los problemas anteriores, el nuevo concepto fue realmente revolucionario y el principio de una nueva era de estudio del átomo y sus posibilidades, por lo que se le considera el padre de la física nuclear.
Quién fue Ernest Rutherford
Ernest Rutherford nació el 30 de agosto de 1871 en Nueva Zelanda. Su padre era granjero y su madre maestra de escuela. Aunque sus padres eran británicos, emigraron a Nueva Zelanda buscando mejores oportunidades y ahí nació Ernest.
Acudió a la escuela e incluso la universidad en Nueva Zelanda pero en 1895 ganó una beca para estudiar en Cambridge, Inglaterra donde estuvo relacionado con JJ Thomson, descubridor del electrón y creador del modelo atómico que lleva su nombre.
Por recomendación del mismo Thomson, Rutherford ocupó un puesto en una universidad de Canadá donde hizo estudios sobre la química de sustancias radioactivas, lo que le hizo merecedor del premio Nobel de Química en 1908.
Ernest regresó al Reino Unido en 1907 a la Universidad de Manchester donde realizó sus mayores aportaciones a la ciencia. En 1908 y años posteriores, Rutherford hizo experimentos, con ayuda de sus asistentes, que lo llevaron a plantear un nuevo y revolucionario modelo atómico en 1911.
En 1914 fue nombrado caballero por sus trabajos en la guerra para detectar submarinos por medio del sónar y en 1917 fue nombrado director del laboratorio Cavendish en Cambridge sucediendo a JJ Thomson. Bajo su mando, varios subalternos ganaron premios Nobel. Por sus incontables logros, en 1931 fue nombrado Barón Rutherford de Nelson, unos años antes de su muerte en 1937.
Contribuciones científicas de Ernest Rutherford
Rutherford tuve varias contribuciones científicas iniciando con sus trabajos con rayos X en gases que sirvieron de soporte al descubrimiento del electrón por JJ Thomson. Estudios de la radioactividad del uranio le permitieron detectar dos tipos de radiación, los rayos alfa y los rayos beta. Pero definitivamente su modelo atómico fue su legado más exitoso.

Si deseas leer más artículos parecidos a Modelo atómico de Rutherford, te recomendamos que entres en nuestra categoría de Física.