Thomas Graham
Actualizado en mayo 24, 2023
Tiempo de lectura estimado: 11 minutos
Thomas Graham (21 de diciembre de 1805 – 16 de septiembre de 1869) fue un químico británico conocido por su trabajo pionero en la diálisis y la difusión de gases. Se le considera uno de los fundadores de la química de coloides.
Biografia de Thomas Graham
Infancia y educación
Hijo de un próspero fabricante, Thomas Graham entró en la Universidad de Glasgow en 1819, a la edad de catorce años, y fue convencido por las conferencias de Thomas Thomson que su vocación estaba en el campo de la química. Su padre, que quería que se convirtiera en ministro de la Iglesia de Escocia, se oponía a esta elección de vocación, pero Graham recibió el estímulo y la ayuda de su madre y su hermana.
Después de recibir el M.A. en Glasgow en 1826, trabajó durante casi dos años en el laboratorio de Thomas Charles Hope en la Universidad de Edimburgo. Luego regresó a Glasgow, donde enseñó matemáticas y química en un laboratorio privado. En 1829 se convirtió en asistente en la Institución de Mecánica, y en 1830 sucedió a Alexander Ure como profesor de química en el Anderson’s College (más tarde el Royal College of Science and Technology), donde produjo su clásico trabajo sobre los fosfatos y arsenatos (1833).

En 1834 Graham se convirtió en miembro de la Royal Society. Tres años más tarde sucedió a Edward Turner como profesor de química en el University College de Londres (más tarde la Universidad de Londres). Su tiempo estaba entonces plenamente ocupado en la enseñanza, la escritura, el asesoramiento sobre la fabricación de productos químicos y la investigación de cuestiones fiscales y de otro tipo para el gobierno. En 1841 participó en la fundación de la Sociedad Química y se convirtió en su primer presidente.
Con la muerte de John Dalton en 1844, Graham quedó como el reconocido decano de los químicos ingleses, sucesor de Joseph Black, Joseph Priestley, Henry Cavendish, William Wollaston, Humphry Davy y John Dalton. Renunció a su cátedra en 1854 para suceder a Sir John Herschel como maestro de la casa de la moneda, puesto que dejó de existir a la muerte de Graham. Murió en 1869, un hombre infatigable pero físicamente quebrantado.
Carrera como docente
Como profesor, Graham era muy querido por sus estudiantes, pero estaba algo nervioso y vacilante. Era muy solicitado como consultor. La mayor parte de su trabajo estaba en el campo de la química inorgánica y física, y se le reconoce como el verdadero fundador de la química de coloides. Su trabajo, generalmente cuantitativamente exacto, era original en su concepción, simple en su ejecución y brillante en los resultados a los que conducía.
Se dice que gran parte de sus primeros trabajos experimentales, algunos de ellos poco precisos, fueron realizados por estudiantes y asistentes. Recibió dos veces la Medalla Real de la Sociedad Real (1837 y 1863), la Medalla Copley de la Sociedad Real (1862) y el Prix Jecker de la Academia de Ciencias de París (1862). Su original y admirable libro de texto Elements of Chemistry fue ampliamente utilizado, no sólo en Inglaterra sino también en el Continente, en su muy ampliada traducción multivolumen por Friedrich Julius Otto.
Trabajo sobre gases – la ley de Graham
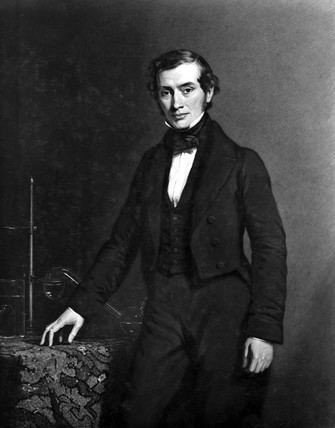
El primer trabajo original de Graham, que apareció durante su vigésimo primer año, trataba sobre el movimiento espontáneo de gases, un tema que le ocupó durante toda su carrera. De hecho, casi todas sus investigaciones no son más que un desarrollo, en diferentes direcciones, de sus primeros trabajos sobre la difusión gaseosa y el agua de hidratación, como cuando demostró que la ley de Enrique no es válida para los gases muy solubles. En otro trabajo encontró que, como la potasa, el amoníaco forma un oxalato normal, binoxalato y quadroxalato, pero que la sosa sólo forma un oxalato y binoxalato normal. También hizo interesantes observaciones sobre el brillo del fósforo y la inflamabilidad espontánea de la fosfina.
En 1829 Graham publicó el primero de sus trabajos relacionados específicamente con el tema de la difusión gaseosa. Aunque esta publicación contiene lo esencial de la ley de Graham, conocida por todos los estudiantes de química general, fue en un trabajo posterior, por el que se le concedió el Premio Keith de la Sociedad Real de Edimburgo, que estableció definitivamente el principio:
La difusión o mezcla espontánea de dos gases en contacto se efectúa por un intercambio en posición de volúmenes indefinidamente diminutos de los gases, cuyos volúmenes no son necesariamente de igual magnitud, siendo, en el caso de cada gas, inversamente proporcional a la raíz cuadrada de la densidad de ese gas… la difusión tiene lugar entre las partículas últimas de los gases, y no entre masas sensibles [«Sobre la Ley de la Difusión de los Gases», en Philosophical Magazine, 2 (1833)].
Graham sostuvo que por medio de esta ley la gravedad específica de los gases podía ser determinada, a través de experimentos sobre el principio de difusión, con mayor precisión que por los medios ordinarios. También señaló que las mezclas de gases podían separarse por difusión, un proceso empleado durante la Segunda Guerra Mundial en Oak Ridge, Tennessee, para separar el isótopo fisionable uranio 235 del isótopo no fisionable uranio 238.
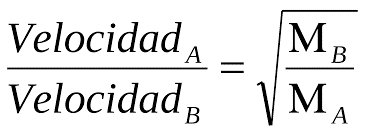
Graham también midió la efusión de los gases a través de un pequeño agujero en una placa metálica y encontró que las velocidades de flujo eran inversamente proporcionales a las raíces cuadradas de las densidades. Sin embargo, en su estudio de las velocidades de transpiración de los gases a través de los tubos capilares, encontró que las velocidades se volvían constantes con una cierta longitud de tubo y no estaban simplemente relacionadas con las densidades.
Más tarde en su carrera, en «Sobre la absorción y separación dialítica de los gases por el septa coloidal», Graham comenzó sus estudios de la penetración del hidrógeno a través de los metales calentados, un fenómeno que llamó «oclusión» y que explicó primero por la licuefacción del hidrógeno y su disolución en el metal. Más tarde supuso que el hidrógeno era el vapor de un metal muy volátil, el hidrógeno, que forma una aleación con el metal. En 1863 incluso sugirió que los diversos elementos químicos podrían «poseer una misma molécula última o atómica que existe en diferentes condiciones de movimiento».
Investigaciones sobre el ácido fosfórico

La mayor contribución de Graham a la química inorgánica es su trabajo «Investigaciones sobre los arseniatos, fosfatos y modificaciones del ácido fosfórico», en el que dilucidaba las diferencias entre los tres ácidos fosfóricos. Esta investigación y el estilo del artículo recuerdan el trabajo de Joseph Black sobre la magnesia y los álcalis realizado en Glasgow ochenta años antes.
El descubrimiento de Graham de la polibasicidad de estos ácidos proporcionó a Justus Liebig la pista del concepto moderno de los ácidos polibásicos. De este trabajo clásico el eminente químico alemán e historiador de la química Albert Ladenburg ha dicho, «tanto ha sido raramente logrado por una sola investigación«. Sin embargo, J. J. Berzelius insistió en que los tres ácidos fosfóricos eran isómeros de P2O5 y ya en 1843 escribió que el «punto de vista de Graham carece de justificación en varios aspectos«.
Antes del trabajo de Graham la relación entre los diversos fosfatos y los ácidos fosfóricos era objeto de la mayor confusión. Los compuestos de un mismo ácido anhidro con una misma base anhidra, en diferentes proporciones, se conocían desde hacía mucho tiempo, pero Graham fue el primero en establecer el concepto de compuestos polibásicos, es decir, una clase de ácidos hidratados con más de una proporción de agua reemplazable por un óxido metálico básico para que se pudieran formar varias series de sales.
Graham llegó a la conclusión de que las propiedades individuales de los ácidos fosfóricos no podían expresarse si se consideraban como anhídridos; debían contener agua químicamente combinada esencial para su composición. Por lo tanto, designó a las tres modificaciones del ácido fosfórico como ácido fosfórico, es decir, 3HO.PO5 (moderno, 3H2O.P2O5 o H3PO4); ácido pirofosfórico, es decir, 2HO.PO5 (moderno, 2H2O.P2O5 o H4P2O7); y ácido metafosfórico, es decir, HO.PO5 o (moderno, H2O.P2O5 o HPO3). En otras palabras, los consideraba respectivamente como un trifosfato, un bifosfato y un fosfato de agua.
Cuando uno de estos compuestos se trata con una base fuerte, se suplanta la totalidad o una parte del agua, pero la cantidad de base en combinación con el ácido permanece inalterada. Así pues, hay tres conjuntos de fosfatos, en los que el oxígeno del ácido es cinco, el oxígeno de la base es tres, dos y uno [«Investigaciones sobre los arseniatos…» en Philosophical Transactions of the Royal Society, 123 (1833)].
Graham resumió la composición de los tres ácidos de fósforo y de sus sales de sodio como se muestra a continuación. Al igual que en su demostración de las relaciones entre el ácido fosfórico y los tres fosfatos de sodio, Graham originó el concepto de compuestos polibásicos; así, en su demostración de que los pirofosfatos y metafosfatos son compuestos que difieren de los fosfatos por la pérdida de agua o de base metálica, originó el concepto de compuestos anhidros.
Thomas Graham, el padre de los coloides
Aunque antes de Graham se habían realizado algunas investigaciones aisladas sobre coloides, sus publicaciones en este campo sentaron las bases de la química de los coloides. En «Sobre la difusión de los líquidos», Graham aplicó a los líquidos el mismo método de investigación que había aplicado a los gases veinte años antes, y consiguió situar el tema de la difusión de los líquidos más o menos en el mismo nivel que el que había planteado el tema de la difusión de los gases antes del descubrimiento de su ley numérica.

Demostró que la velocidad de difusión era aproximadamente proporcional a la concentración de la solución original, aumentaba con el aumento de la temperatura y era casi constante para grupos de sales químicamente similares a concentraciones absolutas (no moleculares) iguales y diferentes con grupos diferentes. Creía que la difusión líquida era similar a la difusión y vaporización gaseosa con soluciones diluidas, pero con soluciones concentradas observó un desvío de la relación ideal, similar a la de los gases que se acercan a la licuefacción bajo presión.
Basándose en su trabajo sobre la ósmosis, Graham desarrolló lo que llamó un «dializador» que usó para separar los coloides, que dializaban lentamente, de los cristaloides, que lo hacían rápidamente. Preparó coloides de ácido silícico, alúmina, óxido férrico y otros óxidos de metales hidratados, y distinguió entre soles y geles.
Gran parte de la terminología y los conceptos fundamentales de este campo se deben a Graham:
Como la gelatina parece ser su tipo, se propone designar las sustancias de la clase como coloides [κόλλα – pegante], y hablar de su forma particular de agregación como la condición coloidal de la materia. Opuesta a la condición coloidal está la condición cristalina. Las sustancias que afectan a esta última forma se clasificarán como cristaloides… Los coloides fluidos parecen tener siempre una modificación pectónica [πηκτός, cuajada]; y a menudo pasan bajo las más ligeras influencias de la primera a la segunda condición… El coloide es, de hecho, un estado dinámico de la materia; siendo el cristaloide la condición estática.
Thomas Graham declaró que los cristales y los cristaloides «parecen mundos de materia diferentes», pero reconoció que la diferencia esencial está en el estado y que la misma sustancia puede existir en el estado cristaloide o coloide. Concluyó que «en la naturaleza no hay transiciones bruscas, y las distinciones de clase nunca son absolutas».
Para más información Thomas Graham

Como citar este artículo:
APA: (2020-12-21). Thomas Graham. Recuperado de https://quimicafacil.net/infografias/biografias/thomas-graham/
ACS: . Thomas Graham. https://quimicafacil.net/infografias/biografias/thomas-graham/. Fecha de consulta 2024-04-19.
IEEE: , "Thomas Graham," https://quimicafacil.net/infografias/biografias/thomas-graham/, fecha de consulta 2024-04-19.
Vancouver: . Thomas Graham. [Internet]. 2020-12-21 [citado 2024-04-19]. Disponible en: https://quimicafacil.net/infografias/biografias/thomas-graham/.
MLA: . "Thomas Graham." https://quimicafacil.net/infografias/biografias/thomas-graham/. 2020-12-21. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net