Qual é a teoria atômica de Thomson?
O modelo atômico de Thomson foi proposto no ano de 1897, sendo o primeiro modelo a apresentar a ideia de divisibilidade do átomo. Para ele, o átomo deveria ser formado por uma esfera com carga elétrica positiva possuindo elétrons na sua superfície.
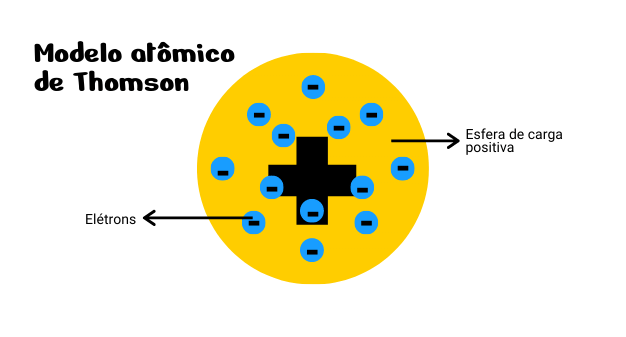
Assim, a carga elétrica seria neutra, uma vez que a carga elétrica positiva e negativa se compensariam. Esse modelo é conhecido como “modelo pudim de passas” por ser semelhante a esse alimento.
Qual o experimento realizado por Thomson?
Os experimentos realizados pelo cientista inglês Joseph John Thomson (1856-1940) utilizaram o tubo de raios catódicos.
O tubo de raios catódicos ou ampola de Crookes é um dispositivo que foi criado por Willian Crookes (1832-1919) que apresentava um tubo de vidro vedado contendo uma atmosfera rarefeita (gás com baixa pressão) em que se aplicava uma alta voltagem ao sistema. Essa tensão era aplicada devido à presença de um ânodo e de um cátodo no interior do tubo. Sendo assim, ao ser ligado observava-se os raios indo do cátodo (polo negativo) ao ânodo (polo positivo).
Desse modo, para a verificação das propriedades das partículas, Thomson adicionou duas placas elétricas ao redor dos raios catódicos: uma positiva e outra negativa. Diante dessas placas, os raios desviaram-se da placa negativa e iam em direção a placa positiva. Este comportamento permitiu que Thomson concluísse que os raios catódicos eram formados por partículas carregadas negativamente.
Além das placas elétricas, Thomson também adicionou dois ímãs, observando que o campo magnético também desviava o trajeto dos raios catódicos. Com esse experimento, ele conseguiu determinar a razão entre a massa e a carga elétrica dos raios catódicos.
É importante ressaltar, que os experimentos foram realizados com raios catódicos de outros elementos, observando-se o mesmo comportamento. Sendo assim, as observações e conclusões realizadas por Thomson eram válidas para qualquer tipo de átomo.
Conclusões do experimento de Thomson
Diante dos resultados observados pelo experimento com raios catódicos, foi possível concluir:
- O átomo é esférico, mas não é indivisível;
- A carga elétrica total do átomo é nula;
- Para que a carga final seja nula, há a presença de partículas positivas e negativas;
- Em determinadas condições, os elétrons poderiam ir de um átomo para o outro;
- O átomo é uma esfera positiva onde se encontram distribuídos os elétrons;
- Modelo de pudim de passas.
Logo, Thomson foi o primeiro a propor algumas novidades ao estudo atômico da matéria:
- Divisibilidade do átomo;
- Carga elétrica da matéria;
- Presença de partículas subatômicas.
Problemas no modelo atômico de Thomson
Apesar de Thomson ter descoberto o elétron e assim, propor a divisibilidade do átomo, seu modelo atômico apresentava alguns problemas, sendo eles:
- Não é possível explicar os fenômenos e propriedades relacionados aos átomos;
- Não há a existência de um sistema estável justificado apenas na repulsão entre as partículas de cargas iguais;
- O elétron não está na superfície da esfera positiva mas sim, se deslocando livremente na eletrosfera ao redor do núcleo.








