La hemorragia intracraneal (HIC) supone un 10-30% de los ictus, siendo la forma de peor pronóstico. Las causas de hemorragia cerebral pueden ser primarias, fundamentalmente la angiopatía hipertensiva y amiloide, o secundarias, como tumores o lesiones vasculares.
Identificar la etiología del sangrado es importante, ya que determina el tratamiento a realizar y el pronóstico del paciente. El objetivo principal de esta revisión es repasar los principales hallazgos por resonancia magnética (RM) de las causas de HIC primarias y secundarias, deteniéndonos en aquellos signos radiológicos que ayudan a orientar hacia un sangrado por una angiopatía primaria o bien secundario a una lesión subyacente. También se revisarán las indicaciones de RM ante una hemorragia intracraneal no traumática.
Intracranial hemorrhage (ICH) accounts for 10-30% of strokes, being the form with the worst prognosis. The causes of cerebral hemorrhage can be both primary, mainly hypertensive and amyloid angiopathy, and secondary, such as tumors or vascular lesions.
Identifying the etiology of bleeding is essential since it determines the treatment to be performed and the patient's prognosis. The main objective of this review is to review the main magnetic resonance imaging (MRI) findings of the primary and secondary causes of ICH, focusing on those radiological signs that help guide bleeding due to primary angiopathy or secondary to an underlying lesion. The indications for MRI in the event of non-traumatic intracranial hemorrhage will also be reviewed.
La hemorragia intracraneal (HIC) supone un 10-30% de los ictus1,2, siendo la forma de peor pronóstico. A pesar de los esfuerzos terapéuticos, la incidencia no ha disminuido y se ha mantenido estable en las últimas cuatro décadas3. Esta incidencia es de 20-24 por 100.000 habitantes/año4 y es mucho mayor en algunas regiones del globo como el sureste asiático3,5.
El papel fundamental del radiólogo es intentar determinar la causa del sangrado, ya que el pronóstico del paciente depende de la rapidez de instauración del tratamiento4. La tomografía computarizada (TC) es suficiente para diagnosticar la hemorragia intracraneal1,6,7, siendo la angio-TC la siguiente prueba a realizar en el momento agudo si se sospecha una lesión vascular8. La resonancia magnética (RM) se utiliza en un segundo tiempo para establecer la etiología de la HIC, ya que nos puede mostrar datos de enfermedad de pequeño vaso o lesiones subyacentes2,9.
Ante una hemorragia cerebral, debemos saber cuándo debemos realizar una RM. La RM es muy útil para determinar la etiología, lo que puede modificar el diagnóstico inicial y tratamiento2,9. Ante una HIC, se recomienda realizar una RM de forma prioritaria10, excepto en los siguientes casos11:
- •
Pacientes > 65 años hipertensos con hematomas en tálamos o en ganglios basales, en cuyo caso asumimos que tienen un origen hipertensivo10.
- •
Pacientes > 85 años con hematomas intracraneales de cualquier localización, especialmente hematomas lobares que presenten características sugestivas de angiopatía amiloide cerebral en la TC craneal, como son la hemorragia subaracnoidea (HSA) o proyecciones digitiformes12.
La angiografía digital por sustracción no está indicada de rutina debido al riesgo intrínseco como procedimiento invasivo. Su principal papel es en los casos donde existe una alta sospecha de una lesión vascular subyacente, cuando los métodos diagnósticos no invasivos no resultan concluyentes4.
El objetivo principal de esta revisión es repasar los principales hallazgos por RM de las causas de HIC primarias y secundarias, deteniéndonos en aquellos signos radiológicos que ayudan a orientar hacia un sangrado por una angiopatía primaria o bien secundario a una lesión subyacente.
Hemorragia en RMEl protocolo recomendado de RM craneal para el estudio de hemorragia intracraneal debe incluir secuencias potenciadas en T1, T2, FLAIR, DWI, T2* o susceptibilidad paramagnética (SWI), y secuencias T1 post-contraste. Adicionalmente, en caso de sospecha de una lesión vascular habría que realizar una angio-RM dinámica, evitando técnicas 3D TOF con contraste porque se superpone la hiperintensidad de señal del hematoma y de las captaciones de contraste con las estructuras vasculares8.
Las hemorragias pasan por cinco estadios según el tiempo transcurrido y su apariencia en la RM varía en función del estadio (tabla 1)2,13.
Estadios evolutivos de las hemorragias intracraneales y su apariencia en RM en secuencias T1 y T2
| Estadio | T1WI | T2WI | Tiempo |
|---|---|---|---|
| HIPERAGUDOOxiHgb intracelular | ISOINTENSO | HIPERINTENSO | Horas |
| AGUDODeoxiHgb intracelular | ISOINTENSO | HIPOINTENSO | Días |
| SUBAGUDO INICIALMetaHgb intracelular | HIPERINTENSO | HIPOINTENSO | Días-1 semana |
| SUBAGUDO TARDÍOMetaHbg extracelular | HIPERINTENSO | HIPERINTENSO | 1 semana – 1 mes |
| CRÓNICO | ISOINTENSO | HIPERINTENSO CON ANILLO HIPOINTENSO | > meses |
En el estadio hiperagudo, se muestran isointensas en secuencias T1 e hiperintensas en secuencias T2, y característicamente muestran un halo hipointenso en secuencias de susceptibilidad paramagnética14.
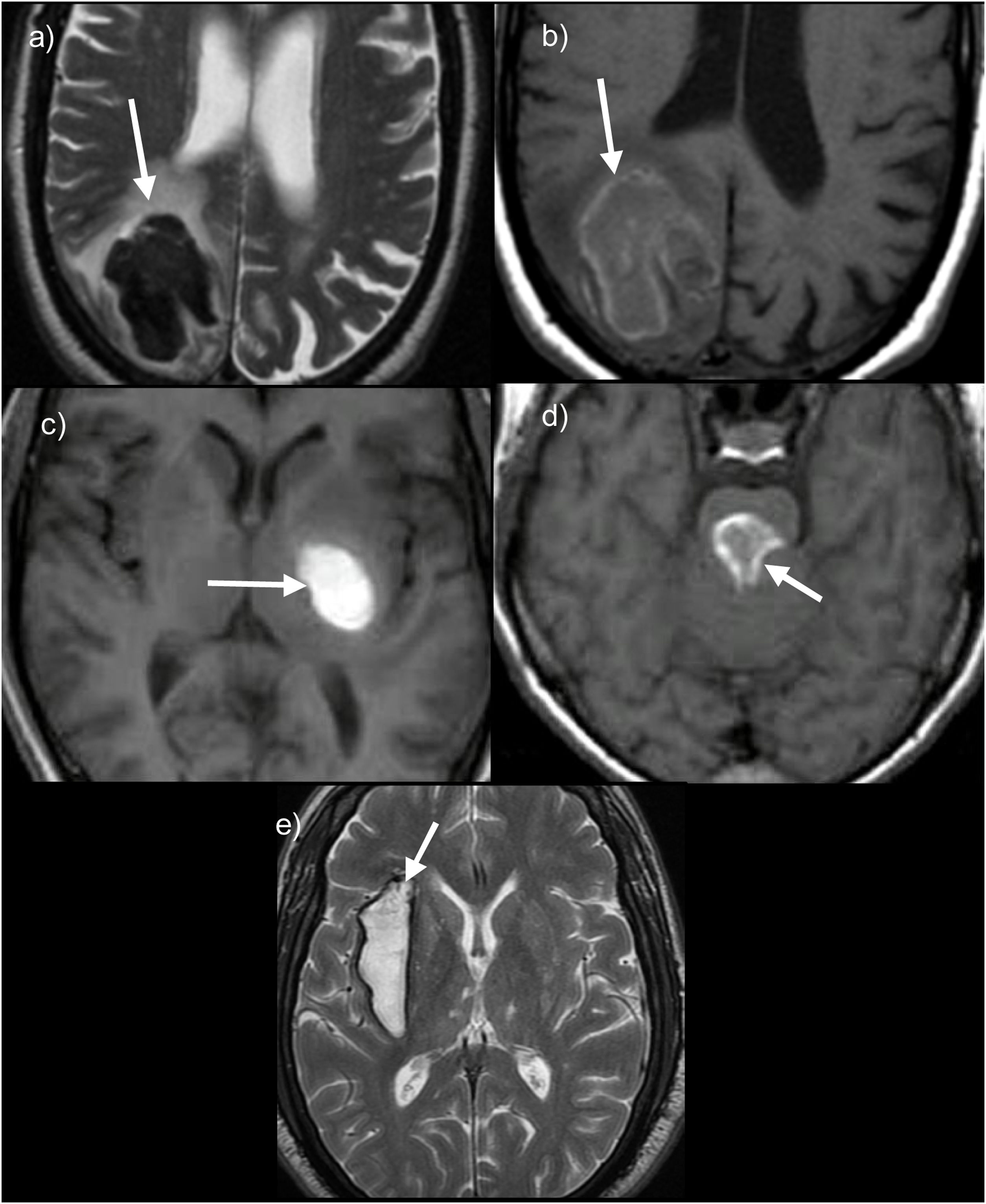
En las fases agudas hay que buscarlas en secuencias T2, donde presentan una marcada hipointensidad de señal (fig. 1).
Ejemplos de los distintos estadios evolutivos de los hematomas intraparenquimatosos en RM. a y b) Hematoma lobar occipital derecho en fase aguda que muestra marcada hipointensidad de señal en secuencias T2WI por la deoxihemoglobina, mientras que en T1 son relativamente isointensos. c y d) Ejemplos de hematomas en fase subaguda que se localizan en ganglios de la base izquierda (c) con señal hiperintensa homogénea en secuencia T1 y en la protuberancia (d) que muestra un halo hiperintenso en T1 con centro hipointenso. e) Hematoma crónico o antiguo con centro hiperintenso y anillo hipointenso en secuencia T2WI.
Las hemorragias subagudas, tanto en la fase inicial como en la fase tardía, se identifican como lesiones muy hiperintensas en secuencias potenciadas en T1 (fig. 1); si son hipointensas en T2 son subagudas tempranas con menos tiempo de evolución, mientras que si son hiperintensas tanto en T1 como en T2 significa que se encuentran en fase subaguda tardía.
Finalmente, los hematomas en la fase crónica presentan un halo muy hipointenso en secuencias T2 o simplemente aparecen como una línea hipointensa (fig. 1), que puede durar indefinidamente. Conviene remarcar que el cambio de una fase a otra comienza desde la periferia y se extiende hacia el centro.
Secuencia de susceptibilidad (SWI)Además de imágenes convencionales potenciadas en T1 y T2, es imprescindible en el estudio de las hemorragias cerebrales realizar secuencias de susceptibilidad. Se trata de imágenes 3D eco de gradiente que utilizan información de magnitud y de fase15.
Permiten visualizar materiales que originan distorsión focal del campo magnético y generan alta susceptibilidad. En nuestro caso, nos interesan los productos de degradación de la sangre, pero también tienen alta susceptibilidad el aire, el metal y el calcio.
Los productos de degradación de la sangre que son paramagnéticos y producen artefacto de «blooming» (aumento en la hipointensidad de señal respecto a su aspecto en T2) son la deoxihemoglobina, la ferritina y la hemosiderina.
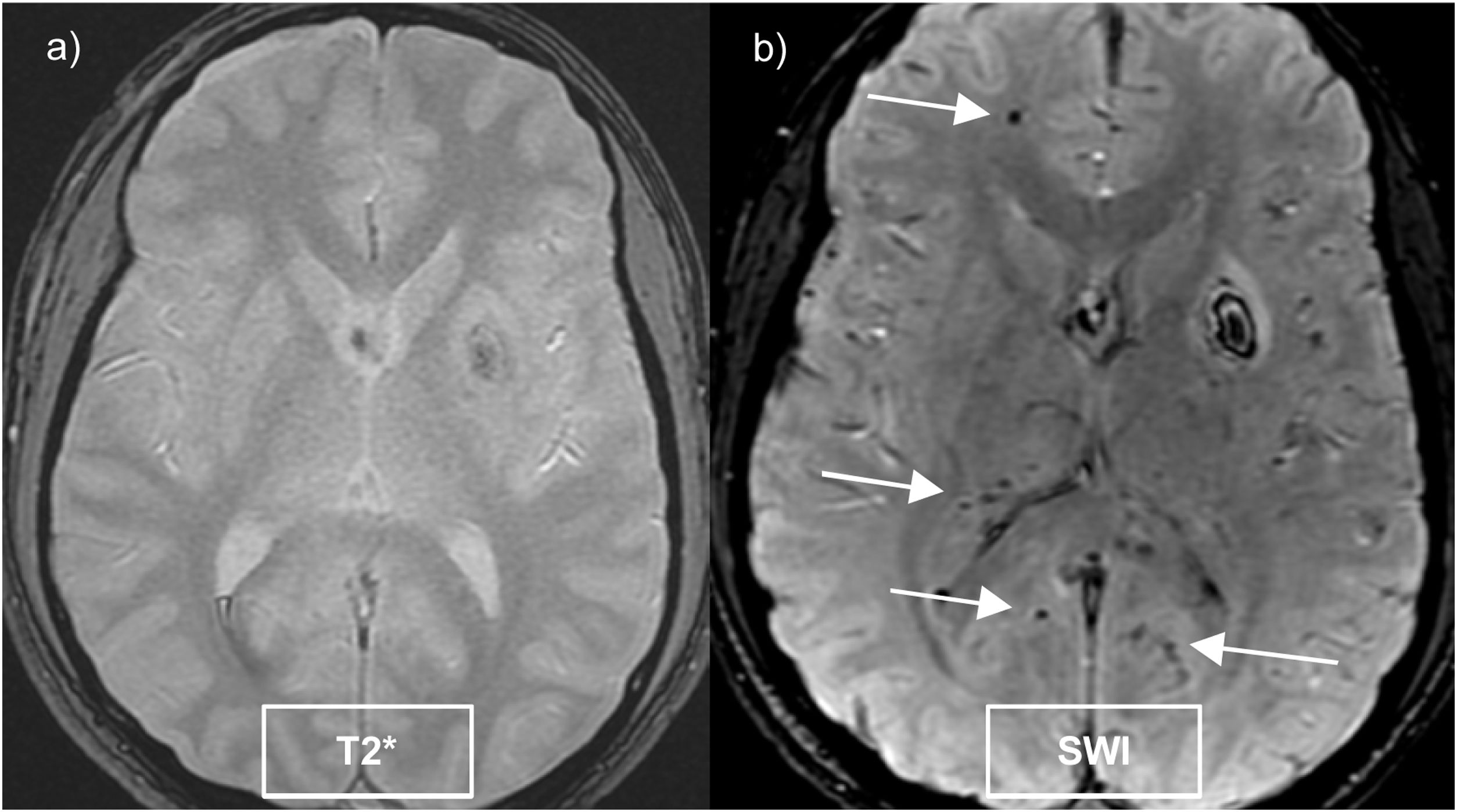
Estas secuencias doblan la detección de microhemorragias respecto a las secuencias eco de gradiente (fig. 2) y son dependientes de la intensidad del campo magnético16.
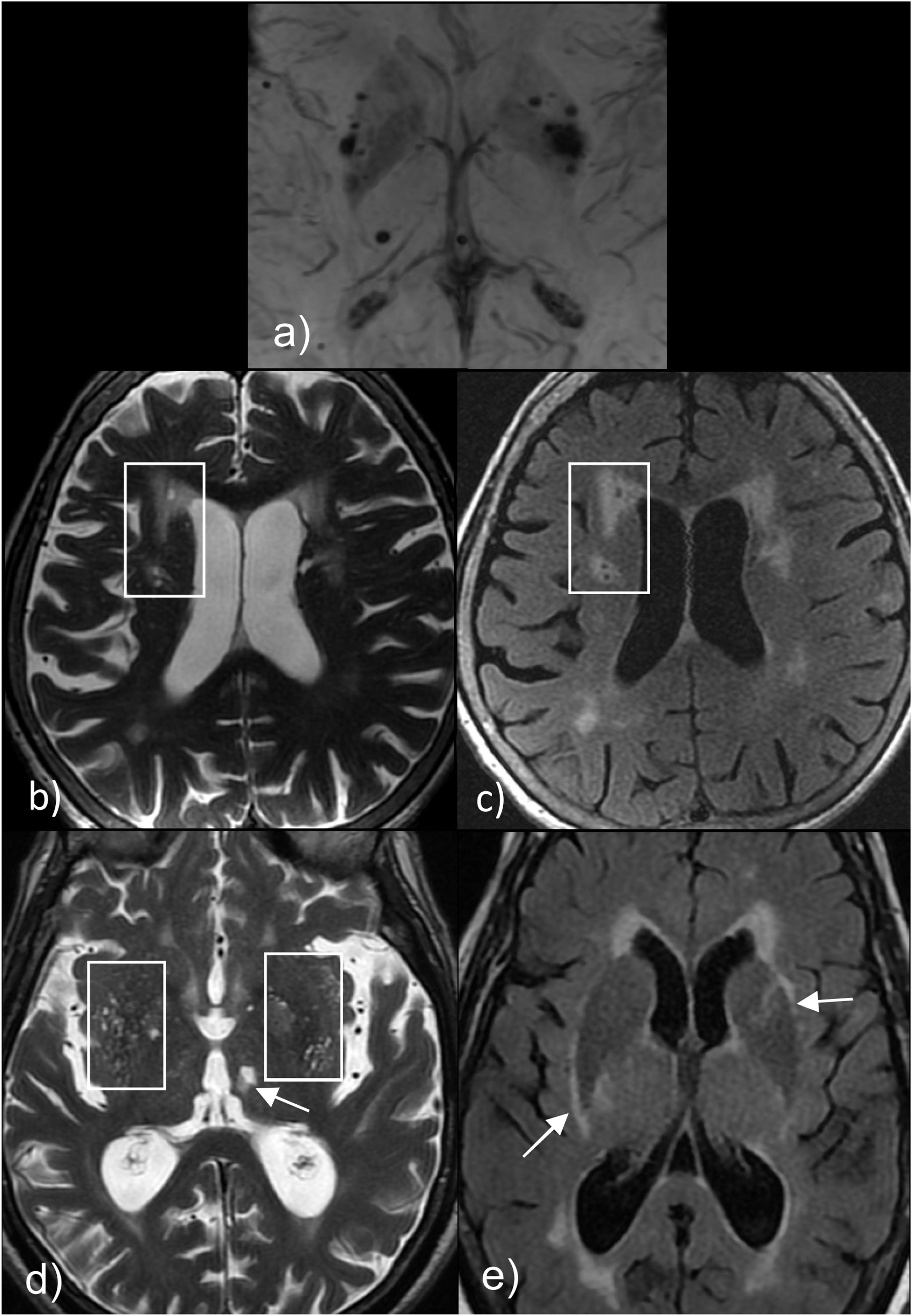
Las microhemorragias cerebrales son pequeños focos hipointensos (de 5-10 mm) detectados en las secuencias de susceptibilidad paramagnética, que histológicamente corresponden a acúmulos de hemosiderina en los macrófagos. Se producen fundamentalmente por enfermedad de pequeño vaso cerebral, siendo las más frecuentes la angiopatía amiloide cerebral esporádica y la angiopatía hipertensiva16.
La frecuencia de las microhemorragias se relaciona con la edad, ya que en pacientes mayores de 80 años se objetivan en aproximadamente un 40%17. Sin embargo, las microhemorragias tienen más relación con los factores de riesgo vascular como la hipertensión, la leucoaraiosis, los infartos lacunares e incluso también con factores genéticos17.
Lo más importante es que representan un marcador de enfermedad cerebrovascular en curso y, por tanto, condicionan mayor riesgo de infarto isquémico17, así como de recurrencia de HIC y de una HIC de novo5,18. Hay que saber que actualmente la presencia de microhemorragias no supone una contraindicación para el tratamiento anticoagulante, antiagregante o trombólisis15.
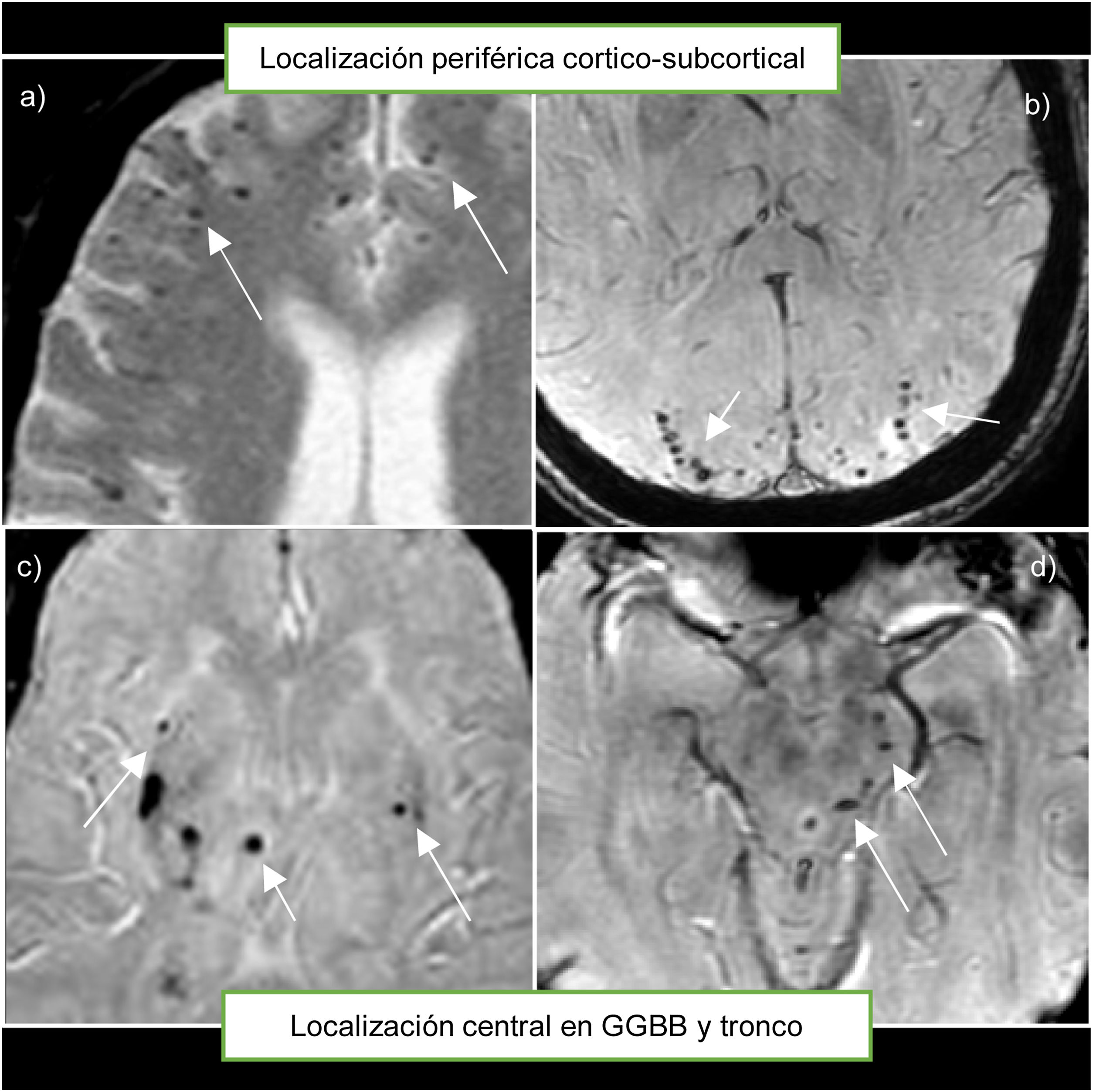
La localización de las microhemorragias se correlaciona con la causa, de tal forma que las microhemorragias lobares situadas alrededor del córtex cerebral y cerebeloso tienen una relación muy robusta con la angiopatía amiloide; en cambio, las localizadas en regiones profundas como ganglios basales, tronco cerebral o núcleos cerebelosos profundos están más asociadas a la angiopatía hipertensiva (fig. 3)17,19.
Localización de las microhemorragias. a y b) Muestran microhemorragias en la típica localización periférica o cortico-subcortical, asociadas a la angiopatía amiloide cerebral. c y d) Muestran microhemorragias en típica localización central en los ganglios de la base y el tronco del encéfalo, asociadas a la angiopatía hipertensiva.
Existen otras múltiples causas infrecuentes de microhemorragias, entre las que encontramos el tratamiento con radioterapia holocraneal, la coagulación intravascular diseminada, los émbolos sépticos, la lesión axonal difusa por traumatismo craneal, la utilización de dispositivos de oxigenación por membrana extracorpórea (ECMO) y la cirugía cardiaca.
Etiología de las hemorragias cerebralesLas hemorragias intracraneales pueden ser de etiología primaria o secundaria (tabla 2). Las causas primarias son las más frecuentes, suponiendo casi el 90%15, e incluyen fundamentalmente la angiopatía hipertensiva y la angiopatía amiloide cerebral.
Etiologías primarias y secundarias de las hemorragias intracraneales de causa no traumática
| ETIOLOGÍA PRIMARIA |
| Angiopatía hipertensiva |
| Angiopatía amiloide cerebral |
| ETIOLOGÍA SECUNDARIA |
| Lesiones vasculares: |
| Malformación arteriovenosa (MAV) |
| Fístula dural arteriovenosa |
| Cavernoma |
| Causas vasculares: |
| Infarto venoso hemorrágico |
| Transformación hemorrágica de infarto arterial |
| Anticoagulación/coagulopatía |
| Drogas |
| Lesiones estructurales: Tumores |
La localización es uno de los factores que pueden ayudar a establecer la etiología de las hemorragias cerebrales, dividiéndose en:
- •
Hematomas lobares: se localizan superficialmente en los hemisferios cerebrales. En los pacientes ancianos, la principal causa es la angiopatía amiloide.
- •
Hematomas no lobares: se localizan en estructuras profundas como son los ganglios de la base, tálamo, protuberancia y cerebelo. La causa principal de este tipo de hematoma es la hipertensión arterial crónica.
Otro factor importante a tener en cuenta es la edad, dado que en los pacientes jóvenes se debe sospechar la posibilidad de una lesión subyacente causante del sangrado.
Hemorragias intracraneales primariasHemorragia en la angiopatía cerebral amiloideLa angiopatía amiloide cerebral (AAC) es muy prevalente, llegando a ocurrir en la mitad de los pacientes ancianos y presenta una importante asociación con la enfermedad de Alzheimer20. Se caracteriza por una acumulación progresiva de beta-amiloide en las paredes de los vasos leptomeníngeos y corticales21, cuya ruptura produce hemorragias de localización lobar, con mayor frecuencia en las regiones posteriores (lóbulos occipitales y temporales posteriores22,23), y generalmente en individuos de edad avanzada.
Existen tres características clínicas que sugieren la posibilidad de angiopatía amiloide: hemorragia lobar espontánea con tendencia a la recurrencia24,25, deterioro cognitivo y demencia26 y déficits neurológicos transitorios («amyloid spells»)21.
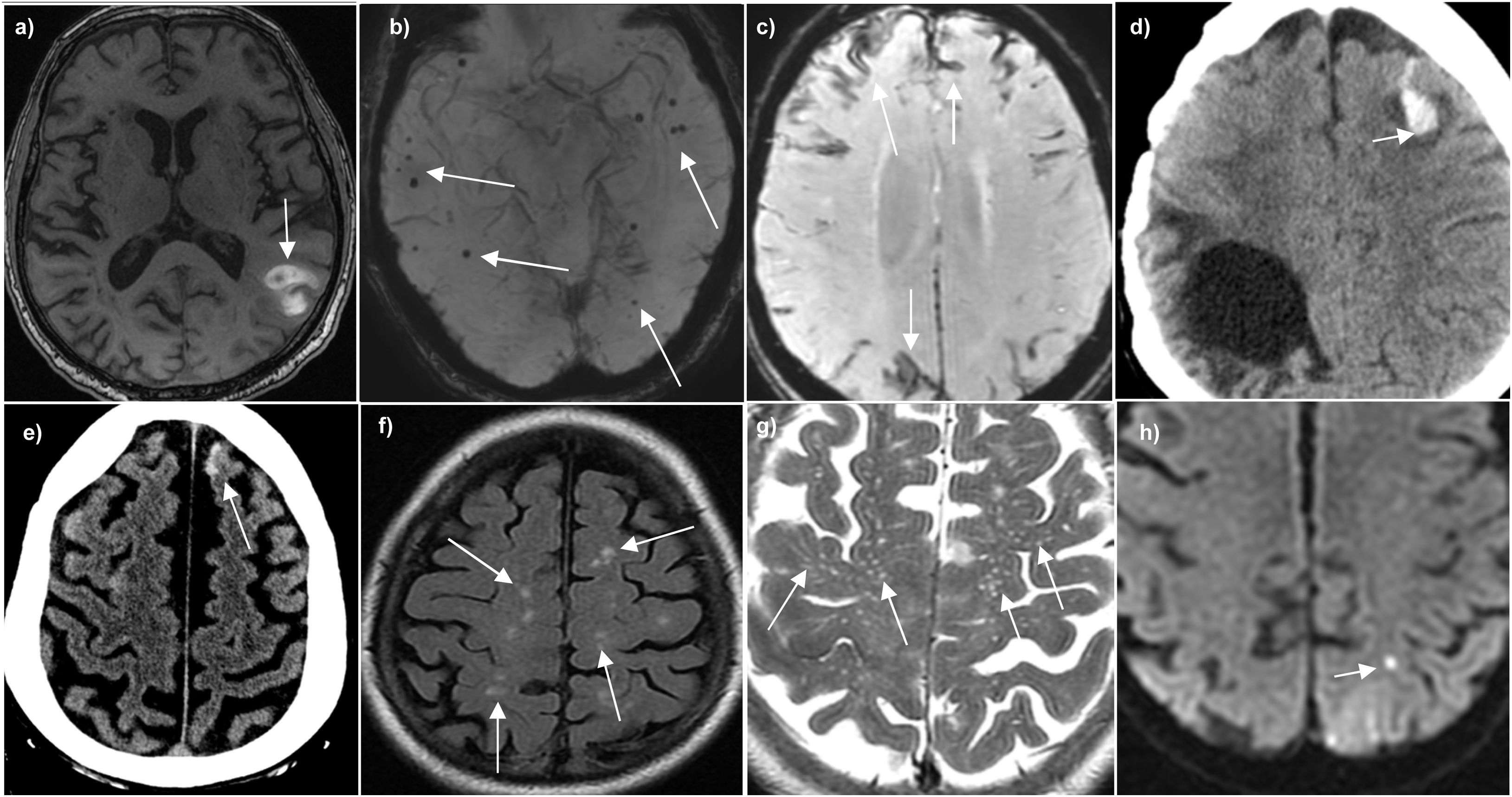
En imagen con RM se han descrito cinco biomarcadores (fig. 4) con importancia diagnóstica27:
- 1.
Múltiples microhemorragias periféricas de localización lobar, que tienen un alto valor predictivo para el diagnóstico de angiopatía amiloide cerebral, incluso en pacientes sin hematomas lobares24.
- 2.
Leucoaraiosis o hiperintensidades en sustancia blanca, especialmente de predominio posterior24 o con «patrón multispot» que se define como ≥ 10 focos hiperintensos en secuencias T2/FLAIR de morfología circular u ovoidea en la sustancia blanca subcortical28.
- 3.
Siderosis superficial cortical. El depósito de amiloide en los vasos leptomeníngeos los vuelve frágiles y proclives a producir una hemorragia subaracnoidea (HSA) focal en los surcos de la convexidad. En pacientes > 60 años, la angiopatía amiloide es la causa más frecuente de HSA en surcos de la convexidad, típicamente en la región pericentral y asociada a los «amyloid spells»10,23. Sin embargo, en jóvenes la causa más frecuente de HSA focal en surcos es el síndrome de vasoconstricción reversible29. En las fases subaguda y crónica, los productos de degradación de la sangre (macrófagos con hemosiderina) se depositan en las capas superficiales del córtex y en la región subpial, dando lugar a la siderosis cortical superficial, que se visualiza en secuencias de susceptibilidad y en T2* como una imagen bilineal hipointensa rodeando uno o varios surcos. Los pacientes con siderosis superficial tienen más riesgo de hemorragias lobares (16%)29 y más frecuencia de episodios neurológicos transitorios («amyloid spells»)30,31.
- 4.
Pequeños microinfartos cerebrales generalmente periféricos.
- 5.
Dilatación de los espacios de Virchow-Robin que se considera un marcador de neuroimagen de enfermedad de pequeño vaso. Concretamente, los espacios perivasculares dilatados en la región del centro semioval o de la convexidad son más frecuentes en las hemorragias intracraneales causadas por angiopatía amiloide; en cambio, en la región de los ganglios de la base, la dilatación de Virchow-Robin y la existencia de infartos lacunares es más característica de la angiopatía hipertensiva.
Biomarcados de imagen de RM asociados a la angiopatía amieloide cerebral. a) Axial T1WI sin contraste con hematoma lobar subagudo que muestra hiperintensidad de señal por metahemoglobina. b) Secuencia de susceptibilidad paramagnética (SWI) que muestra múltiples microhemorragias de distribución periférica. c) Secuencia SWI que muestra siderosis cortical en múltiples surcos. d) Hematoma lobar con HSA asociado en TC. e) HSA aislada en un surco frontal superior izquierdo en un paciente anciano en TC. f) Secuencia FLAIR que muestra múltiples focos hiperintensos en la sustancia blanca con patrón «multi-spot». g) Secuencia T2 que muestra espacios perivasculares de Virchow-Robin en los centros semiovales. h) Secuencia de DWI que muestra un microinfarto periférico.
Para facilitar y estandarizar el diagnóstico no invasivo de AAC, se desarrollaron los criterios de Boston32, que se reemplazaron por los criterios de Boston modificados, y se han actualizado recientemente por los criterios de Boston 2.0 (tabla 3)33, que incorporan estos biomarcadores emergentes de imagen de RM de la angiopatía amiloide.
Criterios Boston 2.0 para el diagnóstico de angiopatía amiloide cerebral
| AAC DEFINITIVA | Diagnóstico post-mortem |
|---|---|
| AAC PROBABLE CON ANATOMÍA PATOLÓGICA | Diagnóstico con apoyo de biopsia de tejido |
| CLÍNICA | CRITERIOS RM* | |
|---|---|---|
| AAC PROBABLE | • > 50 años• Hemorragia lobar espontánea, episodios de déficit neurológico focal, HSA de la convexidad o déficit cognitivo o demencia. | • Al menos 2 de las siguientes lesiones hemorrágicas en cualquier combinación: hemorragia lobar, microhemorragia lobar, foco de siderosis cortical superficial o HSA en la convexidad; o• Hemorragia lobar única con al menos un hallazgo característico de sustancia blanca (incluye múltiples espacios perivasculares dilatados en los centros semiovales o hiperintensidades de señal con un patrón «multi-spot»). |
| AAC POSIBLE | • Al menos 1 lesión hemorrágica: hemorragia lobar, microhemorragia lobar, foco de siderosis cortical superficial o HSA en la convexidad; o• Hallazgo característico de sustancia blanca (incluye múltiples espacios perivasculares dilatados en los centros semiovales o hiperintensidades de señal con un patrón «multi-spot»). |
En caso de no disponer de RM, se publicaron en el año 2018 los criterios de Edimburgo, que incluyen hallazgos de TC para intentar identificar los hematomas espontáneos que se asocian a AAC. Se basan en tres criterios que incluyen apoE4 que no podemos determinar radiológicamente, pero existen otros dos marcadores de imagen importantes que son la asociación de HSA y proyecciones digitiformes («finger-like») del hematoma que aumentan mucho la especificidad34.
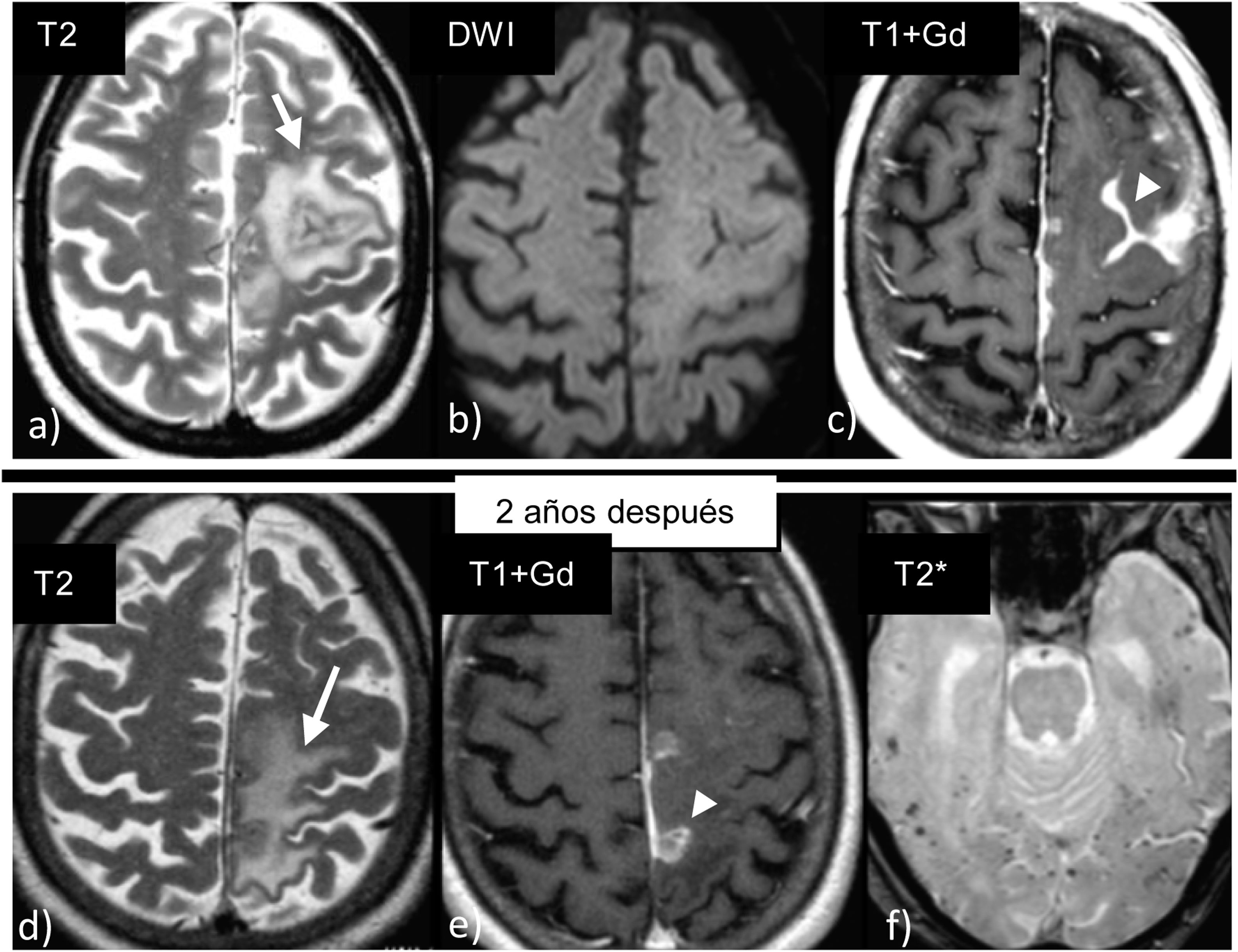
Angiopatía amiloide cerebral asociada a inflamaciónLa angiopatía amiloide cerebral asociada a inflamación (CAA-ri) es un raro síndrome de encefalopatía reversible que ha sido diagnosticado y reconocido en los últimos años. Afecta a un subgrupo de pacientes con angiopatía amiloide, en los que se produce una respuesta inflamatoria inmunomediada35 secundaria al depósito de amiloide en la pared de los vasos unido a un infiltrado inflamatorio perivascular o transmural20.
En el año 2014, Danve et al.36 publicaron unos criterios clínico-radiológicos para su diagnóstico, que posteriormente se modificaron y validaron en 201637, siendo necesario para el diagnóstico que el paciente cumpla todos los criterios:
- •
Edad mayor de 40 años.
- •
Síntomas agudos o subagudos (al menos uno): cefalea, disminución de conciencia, alteración del comportamiento, síntomas neurológicos focales o crisis; no atribuible a una hemorragia intracraneal aguda.
- •
Lesiones hiperintensas en T2/FLAIR de la sustancia blanca con distribución parcheada o confluente (fig. 5), generalmente asimétricas y que se extienden a la sustancia blanca subcortical.
Figura 5.Angiopatía amiloide cerebral asociada a inflamación en un paciente varón de 72 años con crisis. Las imágenes de la fila superior muestran hiperintensidad de señal en T2 (a) en la sustancia blanca izquierda sin restricción en difusión (b) y que se acompaña además de una captación leptomeníngea (c). Ante la sospecha de una angiopatía amiloide inflamatoria, el paciente fue tratado con esteroides con muy buena evolución. Presentó un nuevo brote dos años después, recidivando en una localización diferente (d y e). En las secuencias eco de gradiente (f), presentaba además las múltiples microhemorragias corticales características de la angiopatía amiloide.
(0,53MB). - •
Presencia de ≥ 1 de las siguientes lesiones hemorrágicas cortico-subcorticales: macrohemorragia cerebral, microhemorragia o siderosis cortical superficial.
- •
Ausencia de neoplasia o infección.
Aunque no está incluido dentro de los criterios, está descrito que las lesiones hiperintensas en T2/FLAIR se pueden asociar con captaciones leptomeníngeas o corticales37,38, incluso en aislados casos de la literatura ha sido el único hallazgo radiológico39.
La biopsia cerebral, que muestra inflamación perivascular o transmural y depósitos de amiloide en los vasos corticales, es importante para el diagnóstico en los casos en los que los hallazgos radiológicos sean atípicos35.
A diferencia de la angiopatía amiloide convencional, esta angiopatía amiloide asociada a inflamación es raro que curse con hemorragias40 o con siderosis superficial. El tratamiento inicial es con corticoides41 y, a su vez, la buena respuesta a esta terapia apoya el diagnóstico37. No obstante, algunos pacientes recidivan o son resistentes al tratamiento, en cuyo caso necesitan tratamiento con inmunosupresores.
Hemorragia en la angiopatía hipertensivaA pesar de haber mejorado el control de la tensión arterial, la vasculopatía hipertensiva continúa siendo la causa más frecuente de HIC no traumática entre los 40 y 70 años, suponiendo hasta el 55% de los casos10,42. Así pues, el factor de riesgo modificable más importante en la HIC es la tensión arterial alta43.
La hipertensión arterial crónica produce cambios en las arterias de pequeño-mediano calibre, conduciendo a la proliferación subendotelial por necrosis fibrinoide, que produce dilataciones focales de las arteriolas (microaneurismas de Charcot-Bouchard), que las hace frágiles para romperse produciendo hemorragias y sensibles a obstruirse condicionando infartos lacunares10.
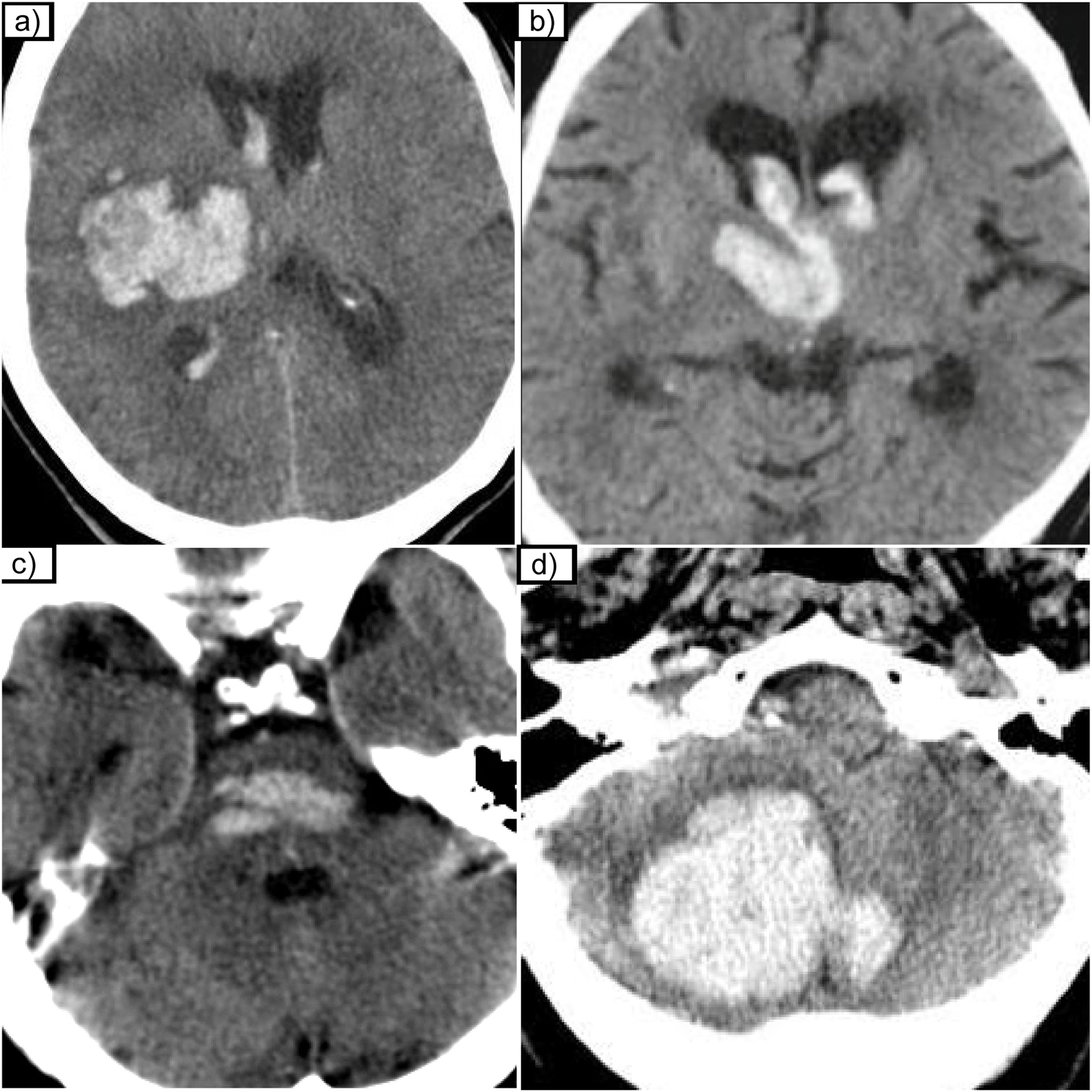
Las arterias lenticuloestriadas perforantes de la arteria cerebral media (ACM) se afectan especialmente y por eso la localización de estas hemorragias tiene predilección por los ganglios de la base (putamen y caudado) en el 60-65% de los casos y tálamo en el 20-25%. Menos frecuentemente, también pueden comprometerse las ramas perforantes paramedianas de la arteria basilar o perforantes de las arterias cerebelosas y se producen hemorragias de tronco o de cerebelo en aproximadamente el 10% de las ocasiones (fig. 6).
Otros hallazgos de imagen asociados a la angiopatía hipertensiva son los infartos lacunares, hiperintensidad de señal lineal en secuencias T2/FLAIR rodeando los ganglios de la base, los espacios perivasculares dilatados centrales24,28, así como la presencia de microhemorragias de localización profunda en los ganglios de la base y en el tronco del encéfalo (fig. 7).
Hallazgos de la RM asociados a la angiopatía hipertensiva. a) Microhemorragias centrales en ganglios de la base y tálamo. b y c) Secuencias T2 y FLAIR con infartos lacunares crónicos en el centro semioval derecho. d) Secuencia T2 que muestra espacios perivasculares dilatados en la región de los ganglios de la base (GGBB) y un infarto lacunar talámico antiguo izquierdo. e) Secuencia FLAIR que muestra hiperintensidades de señal de localización central/peri-GGBB.
El crecimiento de un hematoma de etiología hipertensiva es frecuente y ocurre en un tercio de los pacientes en las primeras seis horas. El «spot-sign», que se manifiesta como la extravasación de contraste en el interior del hematoma, visible tanto en angio-TC como en angio-RM, indica un sangrado activo y se considera un factor de crecimiento independiente y de peor pronóstico42,44. De hecho, la presencia del «spot-sign» es rara en los hematomas de causa secundaria y es un signo específico de hematoma de causa primaria45.
Otros hallazgos como la presencia de niveles, densidad interna heterogénea y márgenes irregulares están también asociados con mal pronóstico y expansión del hematoma46.
Hemorragias secundariasLas causas de hemorragia intracraneal secundaria son:
- •
Lesiones estructurales: tumores cerebrales, tanto primarios como secundarios.
- •
Lesiones vasculares que incluyen malformaciones arteriovenosas, fístulas durales y cavernomas.
- •
Causas vasculares: infartos hemorrágicos tanto de causa arterial como venosa, así como las hemorragias producidas por coagulopatías, incluida la anticoagulación, y por la ingesta de drogas simpáticomiméticas.
Hay que remarcar que la localización es extraordinariamente importante para ayudarnos a buscar la etiología de la hemorragia secundaria:
- •
La localización parenquimatosa intracraneal (considerando pacientes jóvenes no hipertensos) no es de gran ayuda porque todas las causas posibles pueden producirla.
- •
La hemorragia del tronco es más específica y se producen por cavernomas y menos frecuentemente por malformaciones arteriovenosas (MAV).
- •
En el cerebelo la causa más frecuente son las malformaciones vasculares tanto malformaciones arteriovenosas como fístulas durales.
- •
La localización intraventricular se produce en pacientes con coagulopatías, con aneurismas de comunicante anterior y también secundaria a MAV.
- •
Las hemorragias múltiples pueden ser causadas por coagulopatías, metástasis o infartos venosos hemorrágicos.
Los tumores malignos son la causa de un 10% de las hemorragias secundarias47. El 15% de las metástasis son hemorrágicas, los tumores que más frecuentemente sangran son el coriocarcinoma, el de tiroides, el de riñón y el melanoma48. La mayoría de las metástasis de melanoma son de tipo melanocítico y debido al contenido de melanina muestran hiperseñal intrínseca en las secuencias T1 sin contraste y escasa susceptibilidad; mientras que las metástasis hemorrágicas muestran hiperseñal en T1, así como un fuerte efecto de susceptibilidad49.
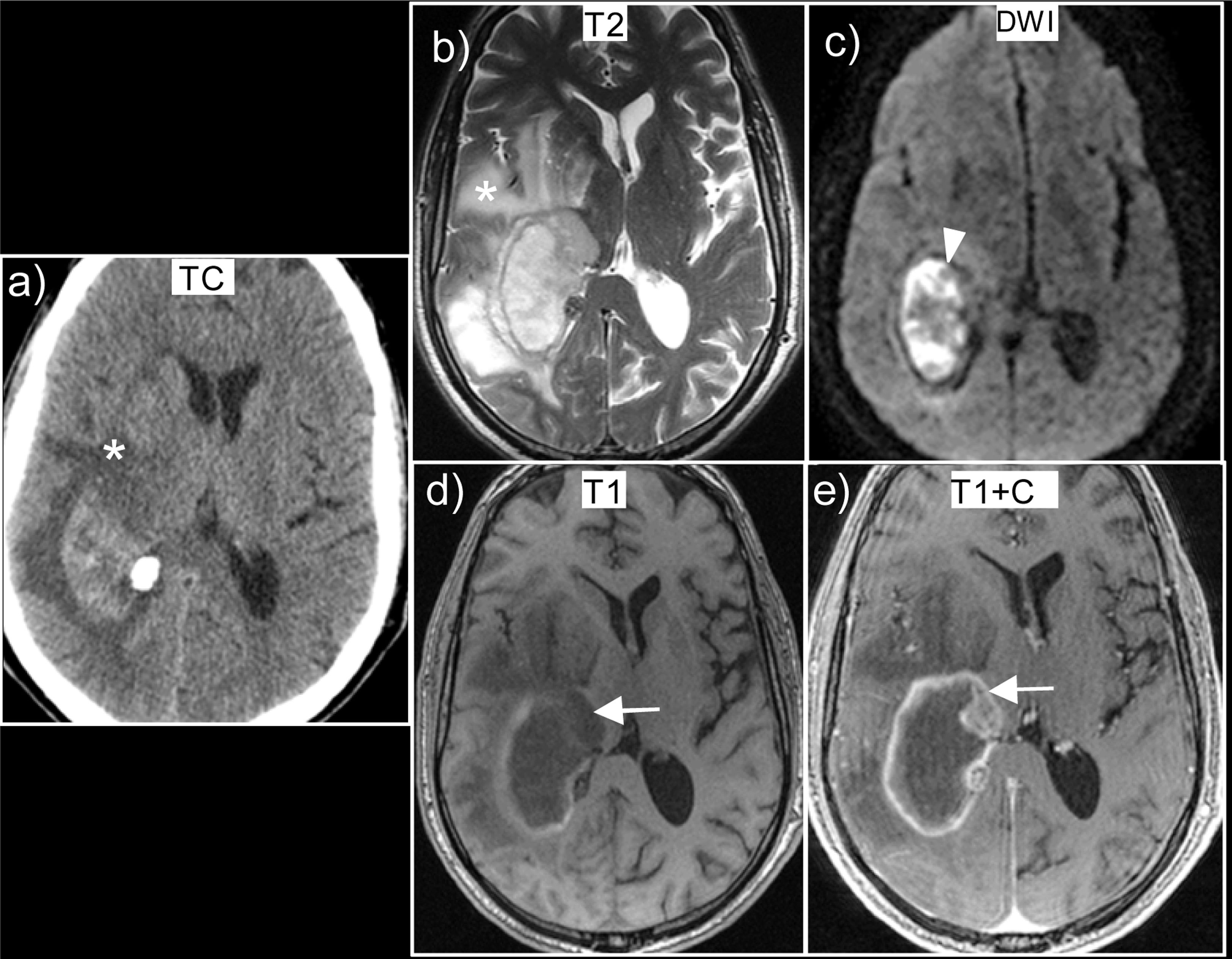
Por otro lado, aproximadamente un 5% de los tumores primarios del sistema nervioso central son hemorrágicos, entre ellos el glioblastoma, el oligodendroglioma y el ependimoma.
Los datos en RM que sugieren hemorragia tumoral (fig. 8) son50,51: hemorragias heterogéneas y complejas con sangre en distintos estadios evolutivos; identificación de tejido tumoral no hemorrágico con captación de contraste; persistencia de edema y efecto de masa en estadios tardíos; la multiplicidad (sugiere la posibilidad de metástasis hemorrágicas); presencia de un halo de hemosiderina irregular o discontinuo con edema persistente o creciente.
Glioblastoma wild-type que se presentó como hemorragia intracraneal. a) Corte axial de TC sin contraste que muestra un hematoma parietal derecho con edema vasogénico (*). En la RM que se realizó a los 7 días, observamos que se trata de un hematoma heterogéneo con sangre en distintos estadios evolutivos, debido a la señal heterogénea en las secuencias T2 (b) y T1 (d). Presenta tejido tumoral captante (flecha) que podemos apreciar en las imágenes de T1 con contraste (e). Presenta extenso edema (*) apreciable tanto en la TC (a) como en las secuencias T2 (b). Obsérvese que al tratarse de hemorragia en fase subaguda (metahemoglobina) muestra restricción (cabeza de flecha) en las secuencias de difusión (c).
La hemorragia intracraneal secundaria producida por malformaciones vasculares supone un 20%10, siendo hasta el 70% de las hemorragias espontáneas en gente joven (< 40 años).
Las malformaciones vasculares que causan hemorragia son las malformaciones arteriovenosas, las fístulas durales y los cavernomas.
Los datos que nos sugieren que pueda existir una hemorragia intracraneal con malformación vascular subyacente son52,53: a) paciente joven menor de 45 años; b) hematoma de localización lobar o en la fosa posterior; c) hematomas de morfología regular; d) ausencia de enfermedad de pequeño vaso; y e) pacientes no hipertensos ni en tratamiento anticoagulante.
Malformación arteriovenosa (MAV)Las malformaciones arteriovenosas (MAV) son lesiones vasculares de alto flujo conformadas por vasos anómalos que contienen un nicho de vasos displásicos que denominamos nidus, nutrido por arterias y con drenaje venoso sin intervención de capilares. Un factor de riesgo importante de sangrado de una MAV es el antecedente de sangrado previo, siendo el riesgo de recurrencia del 7-18% en el primer año y del 2-4% en cada año siguiente54.
Hay que destacar dos datos técnicos importantes en el estudio de hematomas con una posible malformación vascular subyacente (fig. 9):
- •
En primer lugar, es recomendable obtener secuencias potenciadas en T2 de alta resolución para identificar fácilmente los vasos patológicos y el nidus, que se visualizan como estructuras serpiginosas con flujos de vacío. Hay que buscar la malformación arteriovenosa en los bordes del hematoma y no en el centro.
- •
El segundo dato técnico importante es la secuencia que seleccionamos para realizar la angio-RM. Hay que evitar las secuencias 3D TOF con contraste porque al ser secuencias con potenciación T1, se superpone la hiperintensidad del hematoma con las captaciones de contraste. Así pues, ante un hematoma es recomendable realizar secuencias dinámicas o secuencias 4D, porque son más rápidas y suprimen mejor el tejido estacionario.
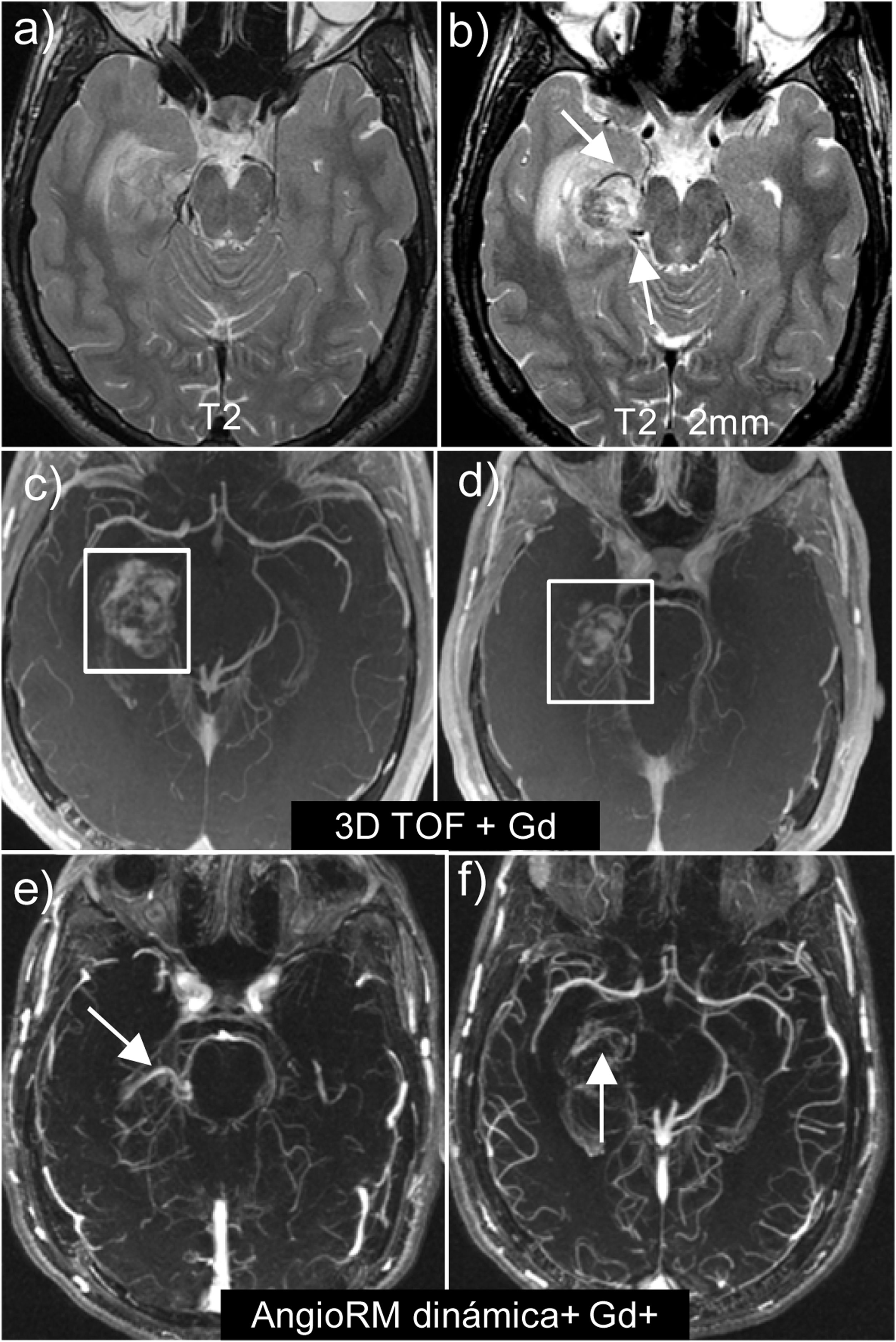
MAV parahipocampal derecha. Obsérvese la utilidad de obtener secuencias T2 de alta resolución y corte fino (2 mm) (b), que nos permiten detectar los vasos patológicos de la MAV, no siendo visibles en secuencias T2 habituales (a). Secuencias 3D TOF con contraste (c y d) donde se superpone la hiperintensidad del hematoma con el contraste en el interior de los vasos de la MAV. Secuencias ANGIO-RM dinámica con contraste 4D (e y f), donde se suprime la señal del tejido estacionario, y nos permite visualizar tanto la aferencia arterial como el drenaje venoso.
Las micro-MAVs son aquellas que presentan un nidus < 1 cm o sin nidus, pero con relleno de una vena precoz. Suponen menos del 10% de las MAV y ocurren en adultos jóvenes. Se presentan frecuentemente en forma de sangrado. En estos casos, así como en los casos donde el nidus está oculto por el hematoma, lo importante es detectar el relleno de una vena precoz dilatada en los estudios vasculares55.
Fístulas duralesLas fístulas durales arteriovenosas intracraneales son anastomosis patológicas entre arterias meníngeas y senos venosos y/o venas corticales. La hemorragia va a ser la forma de presentación aproximadamente en un 25% de las fístulas durales.
Los hallazgos de imagen que sugieren una fístula dural son: ausencia de nidus vascular, drenaje venoso precoz y aumento del número de venas medulares profundas y/o leptomeníngeas secundario a la presencia de drenaje venoso cortical10.
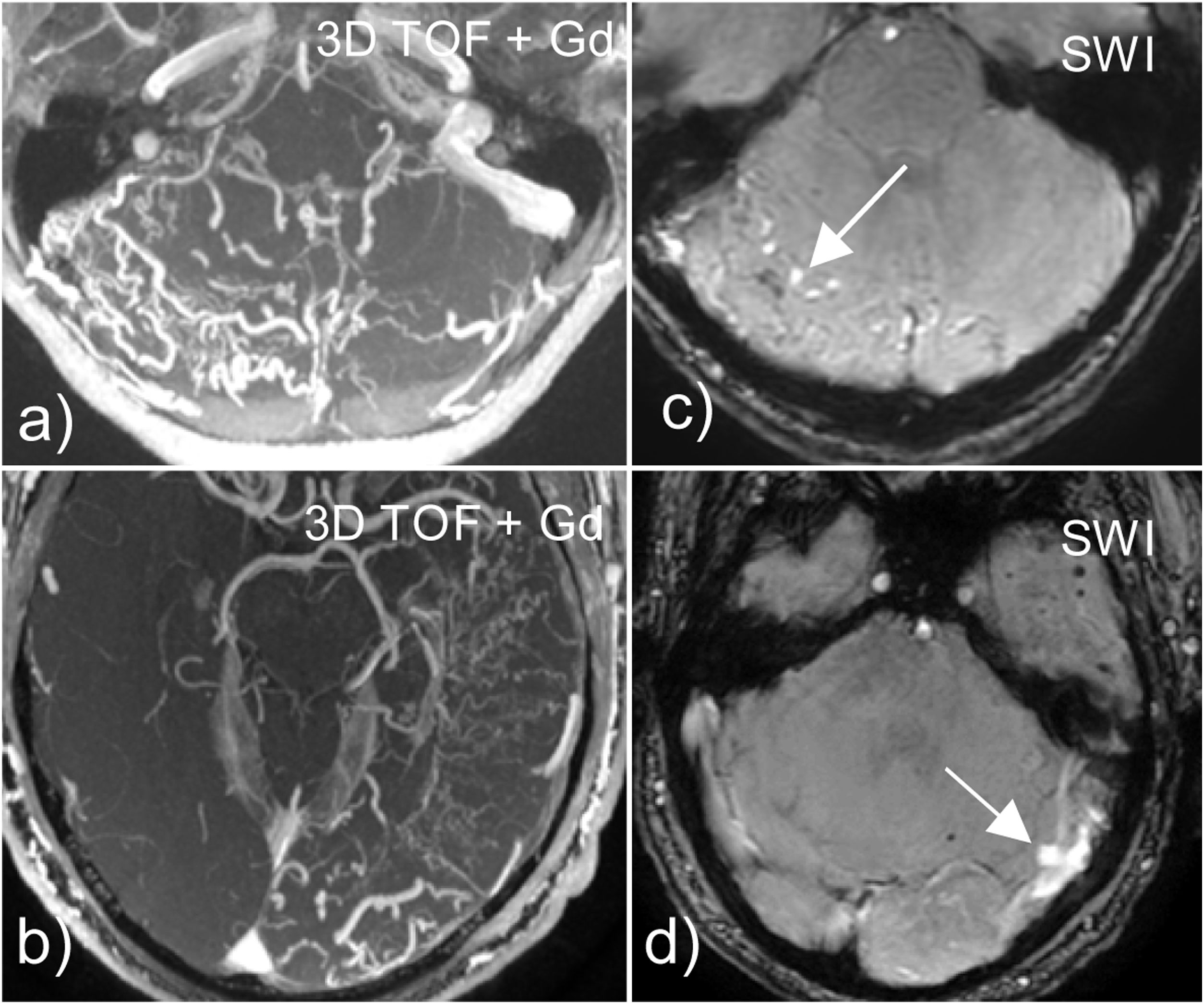
Las secuencias de susceptibilidad son muy útiles para mostrar tanto la anatomía como la hemodinámica venosa de una fístula dural. Permiten ver venas dilatadas que reflejan congestión venosa y además si se identifica hiperintensidad de señal en las venas refleja drenaje retrógrado cortical venoso (fig. 10) y nos puede ayudar en la localización del punto de la fístula56. Los datos radiológicos que nos indican mayor riesgo de sangrado en las fístulas son la existencia de edema, microhemorragias o presencia de una zona hipointensa en secuencias de susceptibilidad.
Utilidad de las secuencias de susceptibilidad paramagnética en el estudio de las fístulas arteriovenosas durales. Las venas de la fístula muestran hiperseñal (flechas) en secuencias de SWI (c y d), lo que refleja el flujo arterializado secundario a drenaje retrógrado cortical venoso y nos ayuda a localizar el punto de la fístula. Tienen una adecuada correlación con las secuencias angiográficas (a y b).
También tienen mayor riesgo de sangrado las fístulas durales que se localizan en el tentorio, en la región frontobasal, en el foramen magno o en la convexidad.
La clasificación de Borden es las más sencilla y se basa en el patrón de drenaje venoso, así las fístulas con drenaje venoso cortical (tipos II y III) presentan mayor riesgo que las fístulas tipo I que carecen de este drenaje y son difíciles de diagnosticar en RM, salvo que utilicemos secuencias de angio 4D o arteriografía convencional57.
CavernomasLos cavernomas son malformaciones vasculares de bajo flujo que se componen de espacios vasculares de pared delgada. Suponen entre el 10-15% de las malformaciones vasculares intracraneales y tienen una prevalencia del 0,4-0,8%58.
La hemorragia de los cavernomas ocurre en un 35,6%58, pero la forma de presentación más frecuente son las crisis59. En niños, el riesgo de hemorragia en un cavernoma es mucho mayor de hasta el 60%. Los cavernomas que tienen mayor riesgo de sangrado son los de localización infratentorial60, los de tamaño grande (> 10 mm), los cavernomas con un sangrado previo10, aquellos asociados a una anomalía del desarrollo venoso y en pacientes jóvenes (< 45 años)61. Existen muchas dudas y controversias sobre si las formas múltiples y el embarazo aumentan el riesgo de hemorragia62.
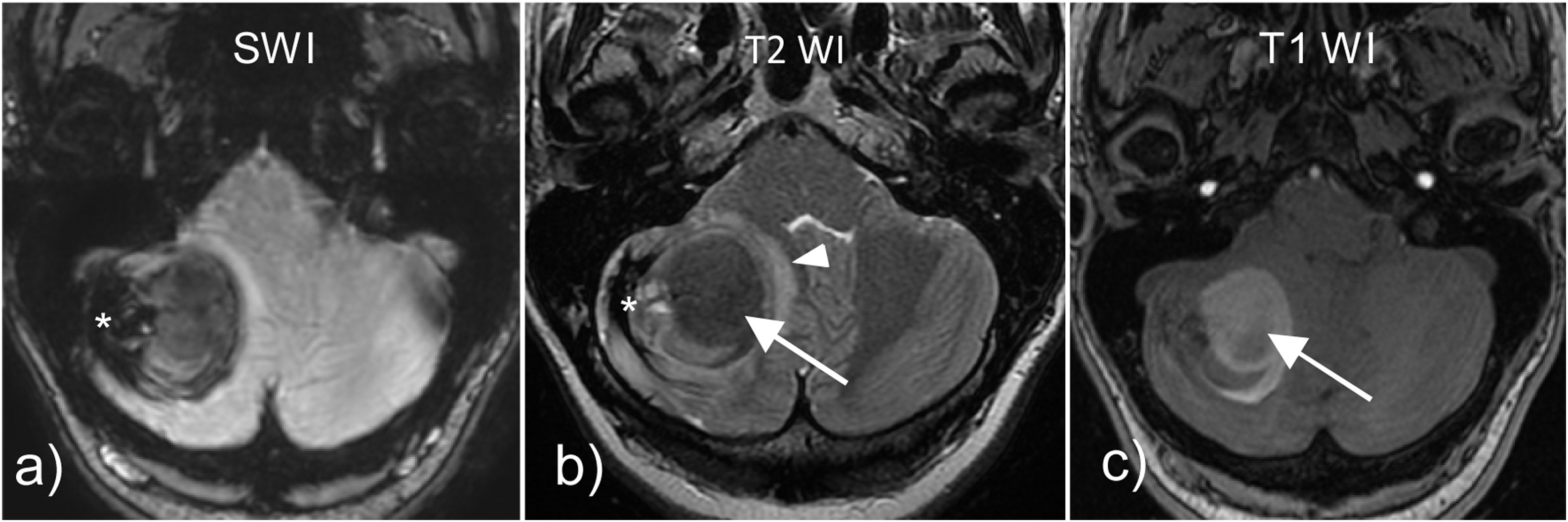
Afortunadamente los sangrados producidos por cavernomas no son extensos ni originan grandes déficits, a diferencia de los sangrados producidos por malformaciones arteriovenosas. En RM, los cavernomas se presentan como lesiones en «palomita de maíz» con un halo hipointenso en secuencias T2 y SWI por el depósito de hemosiderina y con un core de señal variable, sin efecto de masa ni edema. Cuando sangran, se presentan como una imagen «en huevo frito» que corresponde al cavernoma con una hemorragia aguda/subaguda adyacente y fuera del anillo de hemosiderina con edema y efecto de masa (fig. 11), pudiendo existir niveles hemáticos dentro del cavernoma63,64.
Cavernoma hemorrágico en el hemisferio cerebeloso derecho con imagen en «huevo frito», donde podemos observar el cavernoma en el margen lateral derecho que es marcadamente hipointenso en secuencias T2WI (b) con fuerte efecto de susceptibilidad en SWI (a). Este cavernoma presenta un sangrado reciente adyacente (flecha) que muestra hipointensidad de señal en T2WI (b) e hiperintensidad de señal en secuencias T1WI (c). Además, presenta edema vasogénico (cabeza de flecha) asociado visible en secuencias T2WI (b), así como efecto de masa sobre el IV ventrículo.
Se dividen según la clasificación de Zabramski65, que incluye cuatro tipos: el tipo I se caracteriza por presentar un core hiperintenso en T1 en relación con hemorragia subaguda por metahemoglobina; el tipo II presenta un core reticulado con señal mixta en T1 y T2; el tipo III tiene un core iso- o hipointenso en T1 e hipointenso en T2; y el tipo IV se visualiza como focos puntiformes de caída de señal en secuencias de susceptibilidad paramagnética. En el estudio de Nikoubashman et al.62 se añadió un tipo V para incluir aquellos cavernomas con hemorragia extralesional. Esta clasificación se correlaciona con el riesgo de sangrado de un cavernoma, de forma que los tipos I, II y V presentan mayor riesgo de sangrado, siendo casi del 30%, frente a los tipos III y IV (3,4 y 1,3%, respectivamente).
ConclusiónLa hemorragia intracraneal (HIC) supone el 10-30% de los ictus, siendo la forma de peor pronóstico. La TC nos permite detectar y diagnosticar una hemorragia intracraneal, pero mediante la RM podemos determinar la causa del sangrado, siendo fundamental, ya que tanto el tratamiento como el pronóstico dependen de la causa subyacente.
Contribución de los autores- 1.
Responsable de la integridad del estudio: ZHCZ, ARG.
- 2.
Concepción del estudio: ESÁ, AMCdC.
- 3.
Diseño del estudio: ARG, AHB.
- 4.
Obtención de los datos: ESÁ, JRC.
- 5.
Búsqueda bibliográfica: ARG, ZHCZ, AMCdC, JRC.
- 6.
Redacción del trabajo: ZHCZ, ARG.
- 7.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: ARG, AHB, ESÁ.
- 8.
Aprobación de la versión final: ZHCZ, ARG.
Este trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.