La historia de la tabla periódica hasta el 17 de febrero de 1869

El desarrollo de la tabla periódica es uno de los grandes avances científicos del siglo XIX , que continúa en evolución hasta nuestros días. La idea de que la diversidad química se podía explicar de forma sistemática se asocia fundamentalmente a Dimitri Mendeleev y Lothar Meyer, sin embargo, hay muchos más rostros tras esta conquista.
La tabla periódica es uno de los iconos más reconocibles de la ciencia. Algunos la consideran la piedra Rosetta de la naturaleza, ya que permite organizar los componentes básicos de la materia, inferir sus propiedades y predecir sus interacciones.
Los antiguos filósofos griegos reconocían cuatro principios básicos constituyentes de la materia: tierra, agua, aire y fuego, a los que correspondían las formas de los sólidos platónicos. Estos principios eran considerados conceptos abstractos, potencialidades, o tendencias que originaban las propiedades de las sustancias. La idea es consistente con los estados físicos en los que se presenta la materia. Así, la tierra representaba las rocas, el hierro, el oro, el agua, todos los líquidos, el aire todos los gases y vapores, etc.
El descubrimiento del quinto sólido platónico, el dodecaedro, llevó a Aristóteles a proponer el éter, elemento que se asociaría al mundo supralunar. Esta teoría, que perduró más allá de la Edad Media a pesar de ser incorrecta, introdujo la idea de que las propiedades macroscópicas de las sustancias están relacionadas con su estructura microscópica.
Idea moderna de elemento químico
La idea moderna de elemento químico surgió en el siglo XVII, y podemos encontrar un precedente en 1661 en la obra El químico escéptico de Robert Boyle, donde se menciona que «ciertos cuerpos primitivos y simples», que no están formados por otros cuerpos, son los que se combinan y componen los «cuerpos mixtos».

Clasificación de las sustancias simples. 1789 Lavoisier
En 1789 Lavoisier publicó una lista de 33 sustancias simples, identificando elemento con «aquella sustancia pura que no podía descomponerse en otras más sencillas«. La lista incluía la luz y el calórico y otras sustancias que posteriormente, con la mejora de las técnicas de separación y detección, pudieron ser descompuestas en sus elementos constituyentes.
Algunos como el hierro, el oro, el cobre y la plata se conocían desde la antigüedad. Los alquimistas añadirían otros.
El primer elemento que se aisló fue el el fosforo, en 1670, gracias a Henning Brandt. Además, determinados avances científicos y tecnológicos impulsaron el descubrimiento de varios elementos en cortos periodos de tiempo. Por ejemplo, Humphry Davy aisló unos diez (calcio, bario, magnesio, sodio, cloro, etc.) aplicando la técnica de la electrolisis. Muchos más siguieron al descubrimiento de la radiactividad y la fisión nuclear.
Al principio, los siete elementos conocidos se relacionaban con los cuerpos del sistema solar y compartían el símbolo: mercurio,con su homónimo (66); cobre, con venus (11); oro, con el sol (15); plata, con la luna (14); hierro, con marte (10); estaño, con jupiter (13); y plomo, con saturno (12).
Los alquimistas complicaron bastante la simbología, añadiendo, además, sustancias como la sal marina (66), el vino blanco (83), el agua fuerte (53), etc., junto con los cuatro elementos clásicos; agua (34), tierra (36), aire (35) y fuego (33).
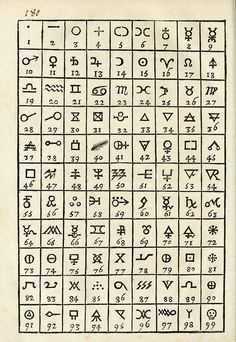
Símbolos alquimistas.
Dalton mantuvo algunos de estos símbolos alquimistas cuando publicó la teoría atómica en 1805, y fue necesario esperar hasta 1813 para que Jöns Jacob Berzelius introdujera los símbolos modernos (Au, Pb, Hg, Sn, Fe…).
Clasificación en grupos
La primera clasificación de los elementos en grupos se basaba más en las propiedades cualitativas que cuantitativas. Las aportaciones de Lavoisier pusieron de manifiesto la importancia de la medida en la química y la necesidad de calcular con exactitud el peso de los átomos. La dificultad de esta empresa en esa época es enorme, ya que no se conocían las formulas de los compuestos, no estaba clara la diferencia entre peso equivalente y peso atómico, etc.
Las tablas disponibles eran bastante inexactas, pero, a pesar de ello, algunos químicos empezaron a organizar los elementos en grupos, teniendo en cuenta las propiedades químicas y el peso atómico.
Así, Döbereiner, en 1817, agruparía los elementos en tríadas, como por ejemplo la formada por el litio, el sodio y el potasio. Se trata de metales de baja densidad cuya reactividad con el agua va aumentando, y en la que se observa que el peso atómico del sodio (23) es intermedio entre el del litio (7) y el potasio (39). Otros grupos estaría formado por el cloro, el bromo y el iodo, o el calcio, el estroncio y el bario.

Representación de los elementos de Dalton.
Esta nueva idea de las tríadas se convirtió en un área de estudio muy popular. Entre 1829 y 1558 varios científicos, como Jean Baptiste Dumas, Leopold Gemelin, Ernst Lessen Max pettenkofer y J.P. Cooke, encontraron que estos tipos de relaciones se extendían más allá de las tríadas. En 1857, el químico alemán Ernst Lenssen publicó un artículo en el que agrupaba los 58 elementos conocidos en veinte tríadas e identificaba siete supertríadas.
La ley periódica
El Congreso de Karlsruhe, en 1860, marcó un hito en la historia de la química. Hasta ese momento esta disciplina era un caos. Algunos químicos no admitía la existencia de los átomos, no estaba clara la distinción entre átomo y molécula, había una enorme confusión entre peso atómico, peso molecular y peso equivalente; y no había acuerdo en la nomenclatura, formulación y símbolos químicos.
A este congreso asistieron, entre otros muchos Mendeleev y Cannizzaro. Este último, basándose en la hipótesis de Avogadro, explicó las diferencias entre átomo y molécula; entre pesos atómicos y moleculares y presentó una tabla de pesos atómicos de los elementos conocidos, calculada en basa a datos experimentales. Esto abrió la puerta al descubrimiento de la ley periódica.
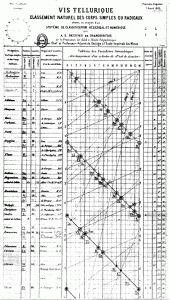
Vis Telurique de Chancourtois 1862.
La primera persona en descubrir la periodicidad química fue Émile de Chancourtois, que al ordenar los elementos según su peso atómico en forma de espiral en torno a un cilindro, observó que aquellos con propiedades químicas similares caían en la misma vertical.
Chancourtois no fue muy afortunado, ya que la primera publicación de 1862, que tuvo más impacto, no incluyó el diagrama de la representación, algo fundamental en el caso de un sistema periódico. Esta idea clave pasó desapercibida entre los químicos, primero, porque fue enunciada por un geólogo. y segundo, porque era adelantada para su tiempo. Su aportación sería reconocida 30 años después de la publicación de su innovador artículo.
En 1863 John Newlands clasificó los elementos en once grupos cuyos componentes presentaban propiedades parecidas y se observó que los pesos atómicos diferían en 8 unidades o en múltiplos de 8.
Un año más tarde propondría la ley de las octavas, según la cual, al ordenar los elementos según el peso atómico, el octavo tenía propiedades similares al primero. Esta idea no fue bien aceptada por la Royal Society of Chemistry. Recibió críticas por varios motivos, entre otros: que no podía colocar elementos recién descubiertos; que no utilizó los pesos de Cannizzaro; que asignó números enteros a los pesos de los elementos; y que algunos elementos no encajaban en la posición adjudicada.
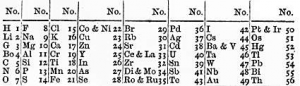
Las octavas de Newlands 1863.
Otras tablas que incluyeron el concepto de periodicidad fueron las de Odling, Hinrichs y Lothar Meyer. En 1864, Meyer publicó Teoría química moderna, un libro de química teórica en el que incluyó dos tablas periódicas parciales. Una de ellas incluía veintiocho elementos ordenados por peso atómico y agrupados en columnas según su valencia. La otra que incluía veintidós. A diferencia de Mendeleev, Meyer sí dejó huecos, pero no llegó a hacer predicciones. En la segunda edición de su libro, publicó la tabla ampliada, que incluía cincuenta y tres elementos, sin embargo, esta tabla se traspapeló y no se publicó hasta 1895

Lothar Meyer 1868.
Si bien Mendeleev había estado trabajando en la clasificación de los elementos durante unos diez años, parece que tuvo su «momento eureka» el 17 de febrero de 1869. Esa tarde planteó un boceto de tabla en el que distribuyó los 63 elementos conocidos, dejó huecos y se atrevió a predecir las propiedades que presentarían los elementos que los ocuparían. Además, a pesar de considerar fundamental el criterio del peso atómico, no dudó en invertir el orden del telurio y del iodo, si bien atribuyó esta anomalía a un error en el cálculo de los pesos atómicos. Mendeleev envió 200 copias de esta tabla a químicos de toda Europa y el 6 de marzo de dicho año se anunció el descubrimiento en una reunión de la Sociedad Química Rusa.

El descubrimiento del argón y la dificultad de situarlo en la tabla, puso a prueba la ley de periodicidad. El tema fue resuelto en 1900 cuando Ramsey informó que este elemento, junto con el helio, neón, kriptón y xenón, que finalmente pudieron ser aislados, constituían un nuevo grupo que se situaría entre los halógenos y los alcalinos.
El estudio del átomo y los avances de la física del siglo XX llevaron a una nueva etapa en la interpretación y explicación de la tabla donde, la física, según Eric Scerri, ha invadido la tabla periódica.
Referencias:
- SCERRI, E. 2007 The periodic table: Its story and its significance,New York Oxford University Press
- BALL, P. 2013. The elements: A very short introduction New York Oxford University Press.
Contenido relacionado
 Dmitri Ivanovich Mendeléiev
Dmitri Ivanovich Mendeléiev
Dmitri Ivánovich Mendeléiev (Tobolsk, 1834 – San Peterburgo, 1907) fue un químico ruso, célebre por haber descubierto el […]
 ¿Qué es la tabla periódica?
¿Qué es la tabla periódica?
En 1869, Dmitri Mendeleiév presentó su primera versión de la tabla periódica compuesta por 63 elementos iniciales, convirtiéndose […]
 Antoine Lavoisier
Antoine Lavoisier
Antoine-Laurent de Lavoisier (París 1743-1794) fue un químico, biólogo y economista francés, considerado el creador de la química […]
 Marie-Anne Pierrette Paulze
Marie-Anne Pierrette Paulze
Marie Anne Pierrette Paulze (Montbrison, 1758 – 1836), es considerada como «la madre de la química moderna». Marie-Anne fue […]
 El oxígeno
El oxígeno
Fue el francés Lavoisier quien acuñó el nombre de oxígeno y escribió el primer trabajo sobre este gas […]
 Oxígeno
Oxígeno
Oxígeno nos cuenta la historia de este elemento. Divertida obra de teatro sobre el verdadero padre del oxígeno, […]



